
| A、工业用电解熔融AlCl3的方法制金属铝 |
| B、铅蓄电池工作时,正极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O |
| C、电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、a<c<0 |
| B、b>d>0 |
| C、2a=b<0 |
| D、2c=d>0. |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签 |
| B、制备Fe(OH)3胶体时,应向沸水中逐滴加入1mol?L-1的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 |
| C、用托盘天平称取5.85g NaCl,称量时砝码放在右盘,氯化钠放在左盘 |
| D、用50mL量筒量取5.6mL浓硫酸 |
| E、用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出 |
| F、用广泛pH试纸测得某溶液的pH为4.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把100 mL 3 mol?L-1的H2SO4溶液跟100 mL H2O混合,硫酸的物质的量浓度变为1.5 mol?L-1 |
| B、把200 mL 3 mol?L-1的BaCl2溶液跟100 mL 3 mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是 3 mol?L-1 |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数之比为1:1 |
| B、所含原子数之比为2:3 |
| C、质量之比为1:1 |
| D、氧原子数之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I2 |
| B、KI |
| C、KIO3 |
| D、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 的摩尔质量是 98 g |
| B、1 mol H2O的质量是 18 g/mol |
| C、Cl-的摩尔质量是 35.5 g/mol |
| D、1 mol H2O中含有2 mol H和1 mol O |
查看答案和解析>>
科目:高中化学 来源: 题型:
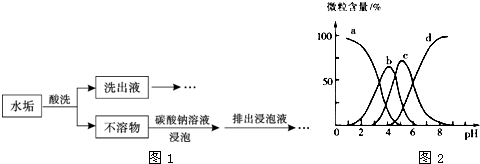
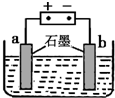
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com