
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
【答案】(1)P4(s,白磷)===4P(s,红磷) ΔH=-29.2 kJ·mol-1
(2)3∶1 1323.45 kJ(3)-1326 kJ·mol-1
【解析】(1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)===4P(s,红磷) ΔH=-2983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。
(2)n(白磷)=![]() =0.5 mol,n(O2)=
=0.5 mol,n(O2)=![]() =2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则
=2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则
x+y=0.5,5x+3y=2.25,
解得x=0.375 mol,y=0.125。
反应过程中放出的热量为:2983.2 kJ·mol-1×0.375 kJ·mol-1+1638 kJ·mol-1×0.125 mol=1323.45 kJ。
(3)根据图示,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198 kJ·mol-1+6×243 kJ·mol-1)-12×331 kJ·mol-1=-1326 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________。
(2)同浓度的CH3COO-、HCO、CO![]() 、ClO-结合H+的能力由强到弱的顺序为_____________。
、ClO-结合H+的能力由强到弱的顺序为_____________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 过滤操作时,玻璃棒应靠在三层滤纸的一侧
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )
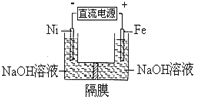
A. 铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B. 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C12H15ClO3)为含多种官能团的芳香族化合物,其结构简式如图所示(其中虚线框内为未知部分的结构),A可发生如下转化(其中部分产物已略去)。
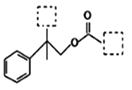
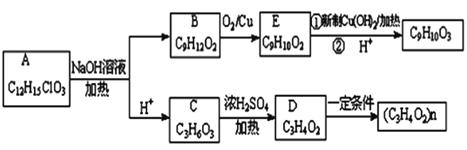
已知:D能使溴的CCl4溶液褪色;B不能与FeCl3溶液发生显色反应,1molB最多能与2mol金属钠反应;C的催化氧化产物不能发生银镜反应。请回答下列问题:
(1)写出E中含氧官能团的名称____________。
(2)写出A的可能的一种结构简式___________。
(3)写出反应类型:C→D_________;B→E__________。
(4)写出E与新制Cu(OH)2反应的化学方程式_____________。
(5)E有多种同分异构体,满足下列条件的同分异构体有_______种,写出其中任意一种同分异构体的结构简式____________。(任写一种)
①含有苯环且苯环上只有一个取代基 ②分子结构中含有甲基 ③能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mL物质的量浓度为18.4mol/L的浓硫酸加入水中,稀释成100mL溶液,所得稀硫酸的物质的量浓度是( )
A. 0.46mol/L B. 0.92mol/L C. 4.6mol/L D. 5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com