
 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.

科目:高中化学 来源: 题型:
| A、标准状况下,5.6L CCl4含有的C-Cl共价键数为NA | B、2.4g Mg与足量稀硫酸反应时,失去电子数为0.1NA | C、l L0.5mol.L-1 CuCl2 溶液中含有的 Cu2+数为0.5NA | D、16g氧气和臭氧的混合物中氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,1,12 L氡气(
| ||
| B、7.8 g Na2S和Na2O2混合物中含有的阴、阳离子总数是0.3NA | ||
| C、某温度时1 L pH=6的纯水所含OH-数目为1.0×10-6NA | ||
| D、用惰性电极电解1L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4 g金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:l | B、需加入NaOH溶液1000mL | C、稀硝酸的物质的量浓度是2mol?L-1 | D、最后所得沉淀在空气中充分加热可得固体32g |
查看答案和解析>>
科目:高中化学 来源: 题型:
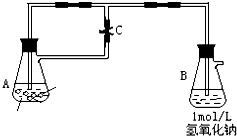 图中为制取纯净且能较长时间存在的Fe(OH)2,药品为铁粉、稀H2SO4,NaOH溶液,当容器A中反应开始后,若分别进行下列操作,请回答有关问题:
图中为制取纯净且能较长时间存在的Fe(OH)2,药品为铁粉、稀H2SO4,NaOH溶液,当容器A中反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
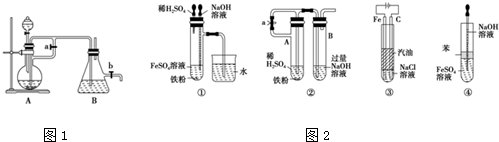
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质a、b、c、d均为中学化学中的常见单质或化合物,它们之间的转化关系如右图所示(部分产物已略去),下列各组物质中,通过一步反应就能实现图示转化的是( )
物质a、b、c、d均为中学化学中的常见单质或化合物,它们之间的转化关系如右图所示(部分产物已略去),下列各组物质中,通过一步反应就能实现图示转化的是( )| 选项 | a | b | c | d |
| A | SO2 | SO3 | S | H2SO4 |
| B | Na2O | Na2O2 | Na | NaOH |
| C | CO | CO2 | C | H2CO3 |
| D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是对环境污染进行综合治理 | B、烟、云、雾在阳光照射下可观察到丁达尔现象 | C、“温室效应”、“酸雨”的形成都与氮氧化合物有关 | D、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com