
| 1000ρw |
| M |
| 1000ρw |
| M |
| 1000×1.5×60% |
| 98 |
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
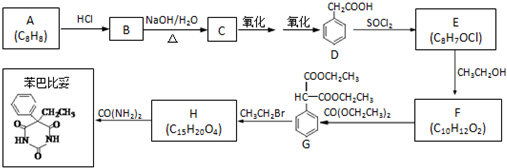
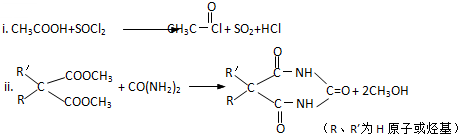
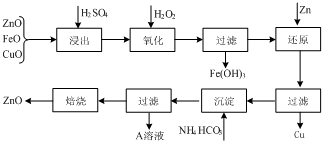
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500ml |
| B、1000ml |
| C、2000ml |
| D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
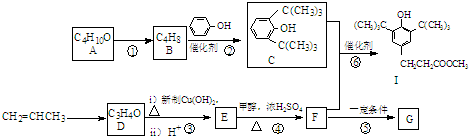

查看答案和解析>>
科目:高中化学 来源: 题型:
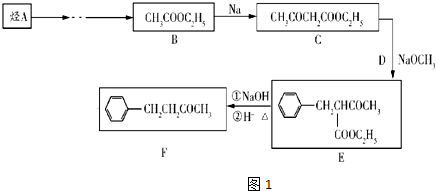
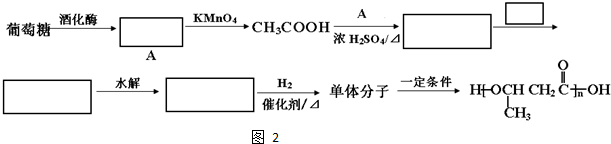
查看答案和解析>>
科目:高中化学 来源: 题型:
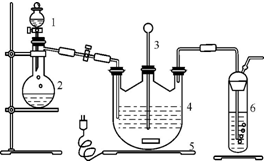 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 |
| B、给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 |
| C、给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热 |
| D、酒精灯在不使用时,必须盖上灯帽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com