
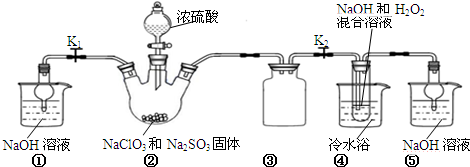
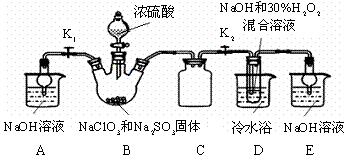
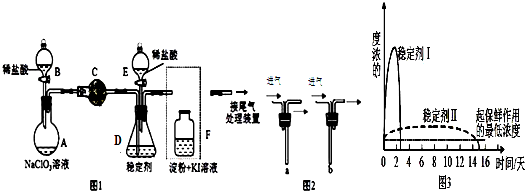
分析 装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氢氧化钠反应生成NaClO2,B中可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2 被带入D中,SO2与H2O2 反应生成硫酸钠,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;装置C的作用是安全瓶,有防倒吸作用,从装置D的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥,装置AE是吸收多余气体防止污染.
(1 )装置②中产生ClO2,亚硫酸钠具有还原性,在反应中作还原剂,生成硫酸钠,结合原子守恒可知,还有水生成,然后配平书写方程式;
(2)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;过滤是将固体不溶物跟液体分离的一种方法,其装置由铁架台、烧杯、玻璃棒、漏斗、滤纸等仪器和用品组成;
(3)根据SO42-的检验方法来分析;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)用Na2S2O3标准液滴定至终点,I2与指示剂淀粉产生蓝色,终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
(6)根据关系式NaClO2~2I2~4S2O32-进行计算.
解答 解:(1)氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式应为2NaClO3+Na2SO3+H2SO4(浓)═2ClO2↑+2Na2SO4+H2O,
故答案为:2NaClO3+Na2SO3+H2SO4(浓)═2ClO2↑+2Na2SO4+H2O;
(2)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,过滤时需用铁架台(含铁圈、各种铁夹)固定漏斗,需用烧杯盛放液体,需用玻璃棒引流,所以用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:用38℃~60℃的温水洗涤;烧杯、漏斗、玻璃棒;
(3)SO42-的检验用氯化钡溶液,取少量晶体溶于蒸馏水,然后滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4;
故答案为:取晶体少许溶于水,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(4)装置①盛放氢氧化钠溶液,用球形干燥管,具有防倒吸功能,所以装置①的作用是吸收装置B中多余的ClO2和SO2,如果撤去④中的冷水浴,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:吸收装置B中多余的ClO2和SO2;NaClO3和NaCl;
(5)因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O32-=2I-+S4O62-,I2与指示剂淀粉产生蓝色,故终点是滴加最后一滴液体时溶液由蓝色变成无色且半分钟内不变色;
故答案为:淀粉溶液;溶液由蓝色变为无色且半分钟不变色;
(6)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag c mol•L-1×V×10-3L×$\frac{100mL}{25mL}$,
所以90.5g:mag=4mol:c mol•L-1×V×10-3L×$\frac{100mL}{25mL}$,
解得a=$\frac{9.05×1{0}^{-2}cv}{m}$.
故答案为:$\frac{9.05×1{0}^{-2}cv}{m}$.
点评 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度中等,注意氧化还原反应滴定中利用关系式进行的计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜是,以粗铜作阴极,精铜作阳极 | |
| B. | 加热0.1mol/L的Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 | |
| C. | 1L 1mol/L的NaClO溶液中含有ClO-的数目为6.02×1023 | |
| D. | 相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
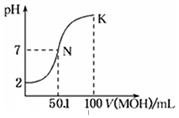 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com