
下列各种物质在一定条件下反应,所得产物种类与反应物 的用量无关的是
①AlCl3(aq)+NH3(g) ②Na2SiO3+HCl ③C+O2
④Fe+HNO3 ⑤Ca(HCO3)2+Ca(OH)2 ⑥C+SiO2
A. ①②⑤ B.②③ C. ①⑤⑥ D.④⑤
科目:高中化学 来源: 题型:
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸
氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
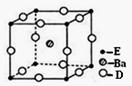
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为____,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名 称是 ,离子的中心原子采用 杂化。
称是 ,离子的中心原子采用 杂化。
 (3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
 (4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A是一种装饰品的主要成 分,根据下图转化关系,回答下列问题。
分,根据下图转化关系,回答下列问题。
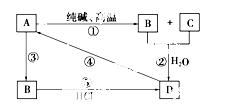
(1)A用途______________(任写一种),B是________,D是________。
(2)写出化学方程式
①________________________________________________________________________。
④________________________________________________________________________。
(3)写出离子方程式
②________________________________________________________________________。
③________________________________________________________________________。
⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀。
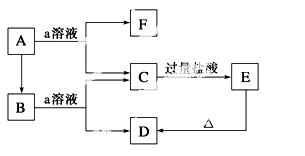
请回答下列问题:
(1)B的化学式是____________,目前B已被用作________的主要原料。
(2)B和a溶液反应的离子方程式是___________________________________。
(3)A和a溶液反应的离子方程式是___________________________________。
(4)C和过量的盐酸反应的离子方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)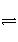
 2C(g)。若2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示反应的平均速率为0.5 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
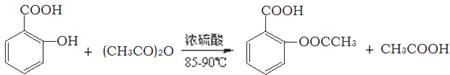
阿司匹林的有效成分是乙酰水杨酸(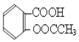 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
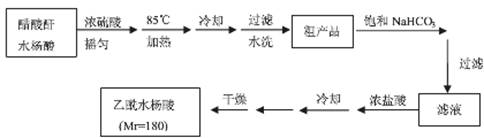
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是 。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式 。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是 。判断该过程结束的方法是 。
② 滤液缓慢加入浓盐酸中,看到的现象是 。
③ 检验最终产品中是否含有水杨酸的化学方法是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):Ⅰ.称取阿司匹林样品m g;
Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式: 。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
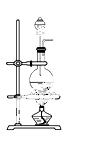 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是_______(填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_______(填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,
探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是____________________________________________。
②进行乙方案实验:准确量取残余清液稀释一定倍数 后作为试样。
后作为试样。
 a.量取试样20.00 mL,用0.100 0 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为__________mol·
a.量取试样20.00 mL,用0.100 0 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为__________mol· L-1;
L-1;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果________(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
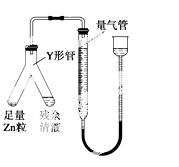
④进行丁方案实验:装置如右图所示(夹持器具已略去)。
(ⅰ) 使Y形管中的残余清液与锌粒反应的正确操作是将________ 转移到________中。
(ⅱ)反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_____________
(排除仪器和实验操作的影响因素)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com