
常温下,下列溶液中的离子浓度关系正确的是
A.pH =3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol?L-1
B.Na2S溶液中:c(Na+)>c(HS-)>c(OH-)>c(H2S)
C.pH =2的盐酸与pH =12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
D
【解析】
试题分析:醋酸是弱酸,部分电离,根据电荷守恒,溶液中c(H+)=c(CH3COO-)+c(OH-),A项错误;硫化钠是强电解质,电离出Na+和S2-,硫离子水解生成HS-,则溶液中离子浓度的大小关系为c(Na+)>c(OH-)>c(HS-)>c(H2S),B项错误;氨水是弱碱,pH =2的盐酸与pH =12的氨水等体积混合,溶液为氯化铵和氨水,溶液显碱性,C项错误;根据越弱越水解,酸性强弱的顺序为CH3COOH>H2CO3 >HClO,NaClO的水解能力最强,其次为NaHCO3 ,水解能力最弱的是CH3COONa ,则pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③,D项正确;选D。
考点:考查离子浓度的大小关系。


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:填空题
(7分)下图是用废铜料(铁、铜混合物)来生产胆矾(CuSO4·5H2O)的过程,请根据图示回答下列问题。

(1)试剂X是___________(填名称)。
(2)途径Ⅱ的化学方程式为____________________________________。
(3)有关途径Ⅰ和途径Ⅱ的说法正确是___________(填编号)
a.途径Ⅰ的操作步骤比途径Ⅱ多,因此采取途径Ⅱ更合理
b.途径Ⅰ相比途径Ⅱ节省原料,且不产生污染
c.相同质量的单质A完全反应生成硫酸铜的量与途径无关
d.每生成1mol B,消耗1mol氧化剂,转移2mol电子
(4)称取25g胆矾,加热冷却后称量固体的质量减少了7.2g,则所得固体的化学式为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质中既能使酸性高锰酸钾溶液又能使溴的四氯化碳溶液褪色的是
A.甲苯 B.环己烯 C.环己烷 D.聚苯乙烯
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高一上学期期期末统考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.Cl2通入水中:
B.NaHCO3溶液中滴加盐酸:
C.钠加入水中:
D.铜片放入HNO3稀溶液中:
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:填空题
(14分)用电化学原理研究金属铝具有重要的意义。
(1)已知:

①工业上利用惰性电极电解熔融的Al2O3冶炼铝,每消耗1000kJ电能时,生成27g铝,则电解过程中能量利用率为____。

③利用Al2O3制备无水AlCl3的反应为
 。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
(2)为了防止钢材腐蚀,常采用电解熔融盐法在钢材表面镀铝。熔融盐中铝元素和氯元素仅以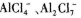 形式存在。如下图所示:
形式存在。如下图所示:
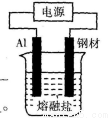
①钢材表面镀铝时,铝应接电源的________极。
②试分析电镀铝时不用氯化铝水溶液作电解液的原因:_______________.
(3)铝一空气-NaOH溶液组成的铝电池性能优越,可用于电动汽车。写出该电池的负极电极反应式______:
(4)铝可用于处理银器表面的黑斑(Ag2S)。将银器置于铝制容器里的食盐水中并与铝接触,形成原电池,可将Ag2S转化为Ag,该过程中食盐水的作用为_______________.
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:选择题
电解饱和食盐水的装置如图,通电一段时间后,下列说法一定正确的是
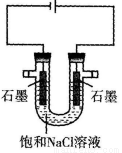
A.滴加适量盐酸,可以使电解质溶液复原
B.在U形管两端分别滴加酚酞试液,右端变红
C.可用中和滴定的方法测定生成的氢氧化钠溶液的物质的量浓度
D.若得到22.4 LH2(标准状况下),理论上需要转移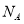 个电子(
个电子( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:选择题
下列与金属腐蚀有关的叙述错误的是
A.生铁的抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.将钢闸门与直流电源的正极相连可防止其被腐蚀
D.轮船外壳在海水中锈蚀的主要原因是发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏回族自治区银川一中高一上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中正确的是
A.3molNO2气体溶于足量水中充分反应转移的电子总数为2NA
B.7.8g Na2O2固体中含有的离子总数为0.4NA
C.标准状况下,11.2L的SO3与足量水充分反应生成的溶液中H+的总数为NA
D.0.5molNa在适量的氧气中燃烧生成Na2O2和Na2O,得到的电子总数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)氧化亚铜(Cu2O)是一种鲜红色粉末状固体,几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①Cu2O+H2SO4 = CuSO4 +Cu+H2O
②Cu2O+ 4HCl = 2HCuCl2 + H2O
③3Cu2O + 14HNO3(稀) = 6Cu(NO3)2 + 2NO↑+ 7H2O
(1)Cu2O中Cu的化合价为_____________。
(2)反应①中氧化剂为____________,还原剂为___________。
(3)反应②_________(填“是”或“不是”)氧化还原反应,若是请说明转移电子情况,若不是请说明判断依据_______________________。
(4)请写出反应③的离子方程式________________________;生成标准状况下22.4L NO,转移电子数为_________,做氧化剂的硝酸的物质的量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com