
 ��ͼ��ʾ��ʵ��װ�ÿ������ⶨ������Ԫ�ص�����X�ķ���ʽ��
��ͼ��ʾ��ʵ��װ�ÿ������ⶨ������Ԫ�ص�����X�ķ���ʽ������ C�����ռ���ˮ��D���ռ���N2��˵������X������ͭ��Ӧ�е�����ˮ���ɣ�����xֻ��������Ԫ�أ�����Ԫ���غ��֪������X����N��HԪ�أ���Ӧ�ռ���������������0.28g�����ʵ���Ϊ0.01mol��B����CuO��O��20.32 g-20.00 g=0.32 g�����ʵ���Ϊ0.02mol�������ɵ�ˮ��HԪ�ص�����Ϊ0.04mol��1g/mol=0.04g����������X������Ϊ0.28g+0.04g=0.32g������X���H2���ܶ�Ϊ16������Է�������Ϊ32���Դ˼�������X�����ʵ��������е�N��Hԭ�ӵ����ʵ������ݴ���д����X�ķ���ʽ��ȷ���ṹ��ʽ���Դ˽����⣮
��� �⣺��1����Ӧ��������������������ɣ���Ӧ��ʵ��ǰ���װ�õ������ԣ��ʴ�Ϊ�����װ�õ������ԣ�
��2��ʵ��ǰB����20.32g��ʵ���B����20.00g��B���еĺ�ɫ��ĩ��ɺ�ɫ��ĩ����֪B����CuO��O��20.32 g-20.00 g=0.32 g�����ʵ���Ϊ$\frac{0.32g}{16g/mol}$=0.02mol��n��H2O��=0.02mol��m��H2O��=0.02mol��18g/mol=0.36g��
�ʴ�Ϊ��0.36g��
��3����ͬ�����£�����X���H2���ܶ�Ϊ16������Է�������Ϊ32��Ħ������Ϊ32g/mol��
��Ӧ�ռ���������������0.28g�����ʵ���Ϊ$\frac{0.28g}{28g/mol}$=0.01mol��B����CuO��O��20.32 g-20.00 g=0.32 g�����ʵ���Ϊ$\frac{0.32g}{16g/mol}$=0.02mol��n��H2O��=0.02mol�������ɵ�ˮ��HԪ�ص�����Ϊ0.02 mol��2��1g/mol=0.04g��
n��N��=0.01mol��2=0.02mol��n��H��=0.02 mol��2=0.04mol�����n��N����n��H��=0.02 mol��0.04mol=1��2������X��ʵ��ʽΪNH2������Է�������Ϊ32�������ʽΪN2H4��
�ʴ�Ϊ��32g/mol��N2H4��
��4������Ŀ��Ϣ��֪��B���еĺ�ɫ��ĩ��ɺ�ɫ��ĩ��˵����Ӧ����Cu��C�����ռ���ˮ��D���ռ���N2��˵������X������ͭ��Ӧ�е�����ˮ���ɣ�������X������ͭ��Ӧ����ͭ��������ˮ����Ӧ����ʽΪ2CuO+N2H4$\frac{\underline{\;\;��\;\;}}{\;}$2Cu+2H2O+N2��
�ʴ�Ϊ��2CuO+N2H4$\frac{\underline{\;\;��\;\;}}{\;}$2Cu+2H2O+N2��
���� ���⿼��������ɵ��ƶϵȣ��Ǽ������ƶϣ�������ѧ���ķ��������������Ŀ��飬�ѶȲ������������غ�����ƶ��ǽ���Ĺؼ�������ע�ػ���֪ʶ�ͻ��������Ŀ��飮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
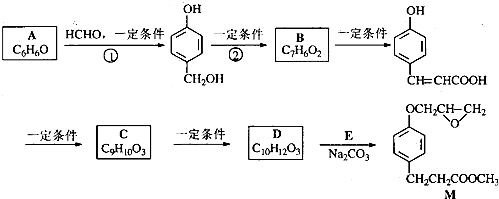
 ��
��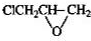 ��
�� ����ʽ��ͬ������ʹ�Ȼ�����Һ����ɫ��ͬ���칹�廹��11�֣������������칹�������к˴Ź�������Ϊ4��壬�ҷ�������Ϊ2��2��1��3�Ľṹ��ʽ��д�������������֣���
����ʽ��ͬ������ʹ�Ȼ�����Һ����ɫ��ͬ���칹�廹��11�֣������������칹�������к˴Ź�������Ϊ4��壬�ҷ�������Ϊ2��2��1��3�Ľṹ��ʽ��д�������������֣���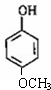 ��
��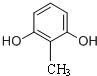 ��
��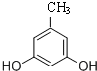 ����2�֣�
����2�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��A��D��C��B | |
| B�� | �ǽ����ԣ�C��D | |
| C�� | �⻯������ȶ��ԣ�C��A | |
| D�� | ����B������������Ũ���ᵫ������������������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ӣ�$\underset{\stackrel{••}{Cl}}{••}$• | B�� | �����ӣ�$\underset{\stackrel{••}{S}}{••}$��2- | C�� | ������[��$\underset{\stackrel{••}{Br}}{••}$��]- | D�� | ������Ca2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | ��������ӦΪ���ȷ�Ӧ | |
| B�� | ��5MPa��800Kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ$\frac{{V}^{2}}{{a}^{2}}$L2•mol-2 | |
| C�� | ��4MPa��1200Kʱ��ͼ��X��ԣ�H2�������ԣ�H2���� | |
| D�� | ��ҵ��ά��6MPa 1000K��������10MPa1000K����Ҫ����Ϊǰ��̼��ת���ʸ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
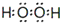 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com