
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol.
② 和 两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣) D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3•H2O),混合后溶液中c(NH4+)与c(Cl﹣)的关系c(NH4+) c(Cl﹣).
考点:
弱电解质在水溶液中的电离平衡;影响盐类水解程度的主要因素;离子浓度大小的比较.
专题:
电离平衡与溶液的pH专题;盐类的水解专题.
分析:
(1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的 ;
;
(2)氨水是弱电解质存在电离平衡,向溶液中加入相同的离子能抑制氨水电离;
(3)根据物料守恒和电荷守恒来分析;
(4)①任何水溶液中都有OH﹣、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
②C中离子关系可知溶液显酸性,且c(Cl﹣)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
③溶液呈中性,则溶液中氢离子浓度等于氢氧根离子浓度,根据电荷守恒确定溶液中铵根离子浓度和氯离子浓度的关系,氯化铵溶液呈酸性,要使溶液呈中性,氨水应该稍微过量.
解答:
解:(1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的 ,所以溶液的pH应该9﹣11之间,故选D;
,所以溶液的pH应该9﹣11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大平衡向左移动,从而抑制氨水电离,故选C;
(3)根据物料守恒知,C(NH4+)+C(NH3.H2O)=0.1mol,根据溶液中电荷守恒得C(Cl﹣)+c(OH﹣)=c(H+)+C(NH4+)+C(Na+),c(H+)+C(NH4+)﹣c(OH﹣)=C(Cl﹣)﹣C(Na+)=0.1mol﹣0.05mol=0.05mol,
故答案为:①NH4+、NH3.H2O;②NH4+、H+;
(4)①因任何水溶液中都有OH﹣、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O⇌NH3.H2O+H+,则c(Cl﹣)>c(NH4+),水解显酸性,则c(H+)>c(OH﹣),又水解的程度很弱,则c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),即A符合,故答案为:NH4Cl;A;
②C中离子关系可知溶液显酸性,且c(Cl﹣)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和HCl;
③氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则盐酸的物质的量浓度小于氨水,溶液呈中性,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈电中性,所以溶液中氯离子浓度等于铵根离子浓度,故答案为:<,=.
点评:
本题考查了弱电解质的电离、离子浓度大小的比较等知识点,根据物质的性质及物料守恒和电荷守恒来分析解答,难度较大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图.关于A的下列说法中,正确的是()

A. 与A属于同类化合物的同分异构体只有2种
B. A在一定条件下可与4 mol H2发生加成反应
C. A分子属于酯类化合物,在一定条件下不能发生水解反应
D. 符合题中A分子结构特征的有机物只有1种
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:A+3B⇌2C+D,在四种不同情况下的反应速率分别为:
①vA=0.15mol•L﹣1min﹣1
②vB=0.6mol•L﹣1min﹣1
③vC=0.4mol•L﹣1min﹣1
④vD=0.45mol•L﹣1min﹣1
该反应进行得最快的是( )
|
| A. | ① | B. | ④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,是该碱溶液的pH等于( )
|
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
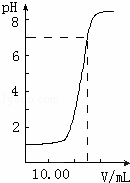
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( )
|
| A. | 盐酸起始浓度为0.1mol•L﹣1 |
|
| B. | NaOH溶液浓度为0.08mol•L﹣1 |
|
| C. | 滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色 |
|
| D. | 滴到中和点时,耗NaOH物质的量为0.002mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的恒容容器中,反应A(s)+2B(g)⇌C(g)+D(g)已达平衡状态的是( )
|
| A. | 混合气体的压强不随时间变化而变化 |
|
| B. | 混合气体的密度不随时间变化而变化 |
|
| C. | 气体总物质的量不随时间变化而变 |
|
| D. | 单位时间内生成n mol C,同时消耗2n molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在容积固定的密闭容器中发生可逆反应:A(气)+2B(气)⇌2C(气)平衡时,各物质的浓度比为c(A):c(B):c(C)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、C,则下列叙述正确的是( )
|
| A. | 刚充入时反应速率v正减少,v逆增大 |
|
| B. | 充入气体后平衡不发生移动 |
|
| C. | 达到新的平衡时c(A):c(B):c(c)仍为1:1:2 |
|
| D. | 达到新平衡状态的过程中,体系压强先增大,后逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.现欲用该浓硫酸配制成1mol/L的稀硫酸.现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸 mL.
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是 .
(3)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 .
(4)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是BCF.
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
Ⅱ.
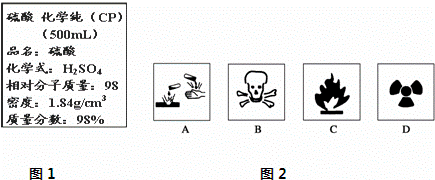
(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的A.
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度 9.2mol/L(填>、<、=)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com