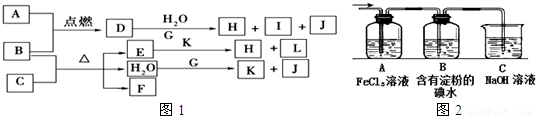
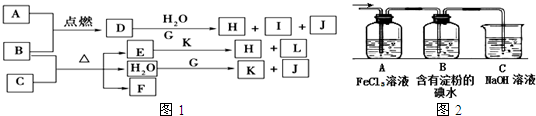
解:由J的元素原子核内只有一个质子知J为H
2;I的焰色反应为黄色,所以I含Na元素;由金属B在A气体中燃烧产生棕黄色烟可知A为Cl
2,B为Fe或Cu,则D为FeCl
3或CuCl
2,;
且D+G+H
2O→H+I+J,结合I含Na元素知G为金属钠,且H
2O+G→K+J(H
2),所以K为NaOH,D的水溶液呈棕黄色,则D为FeCl
3,
其水溶液与Na的反应为:6Na+2FeCl
3+6H
2O═2Fe(OH)
3↓+6NaCl+3H
2↑,F为无色、有刺激性气味气体,且能使品红溶液褪色,应为SO
2,则C为H
2SO
4,E为Fe
2(SO
4)
3,H为Fe(OH)
3,L为NaCl,
(1)K是NaOH,氢氧化钠中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,
故答案为:离子键、共价键;
(2)在氯化铁溶液中加入金属钠,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁反应生成氢氧化铁沉淀,
反应的化学方程式为2Fe
3++6H
2O+6Na=2Fe(OH)
3↓+6Na
++3H
2↑或2Na+2H
2O═2Na
++2OH
-+H
2↑,Fe
3++3OH
-=Fe(OH)
3↓,
故答案为:2Fe
3++6H
2O+6Na=2Fe(OH)
3↓+6Na
++3H
2↑或2Na+2H
2O═2Na
++2OH
-+H
2↑,Fe
3++3OH
-=Fe(OH)
3↓;
(3)G是钠,工业上用电解熔融氯化钠的方法冶炼,反应方程式为:2NaCl

2Na+Cl
2↑,
故答案为:2NaCl

2Na+Cl
2↑,
(4)F是二氧化硫,二氧化硫具有还原性,能被铁离子氧化生成硫酸根离子,同时铁离子被还原生成亚铁离子,离子反应方程式为:SO
2+2Fe
3++2H
2O=SO
42-+Fe
2++4H
+,二氧化硫能被碘氧化生成硫酸,离子反应方程式为:SO
2+I
2+2H
2O=4H
++2I
-+SO
42-,
故答案为:SO
2+2Fe
3++2H
2O=SO
42-+Fe
2++4H
+,SO
2+I
2+2H
2O=4H
++2I
-+SO
42-;
(5)二氧化硫和氢氧化钠反应生成亚硫酸钠和水,亚硫酸钠和二氧化硫、水反应生成亚硫酸氢钠,无论溶液中溶质是亚硫酸钠还是亚硫酸氢钠,溶液中存在电荷守恒,所以的c(Na
+)+c(H
+)=c(OH
-)+c(HSO
3-)+2c(SO
32- ),
故答案为:c(Na
+)+c(H
+)=c(OH
-)+c(HSO
3-)+2c(SO
32- ).
分析:由J的元素原子核内只有一个质子知J为H
2;I的焰色反应为黄色,所以I含Na元素;由金属B在A气体中燃烧产生棕黄色烟可知A为Cl
2,B为Fe或Cu,则D为FeCl
3或CuCl
2,;
且D+G+H
2O→H+I+J,结合I含Na元素知G为金属钠,且H
2O+G→K+J(H
2),所以K为NaOH,D的水溶液呈棕黄色,则D为FeCl
3,其水溶液与Na的反应为:
6Na+2FeCl
3+6H
2O═2Fe(OH)
3↓+6NaCl+3H
2↑,F为无色、有刺激性气味气体,且能使品红溶液褪色,应为SO
2,则C为H
2SO
4,E为Fe
2(SO
4)
3,H为Fe(OH)
3,L为NaCl,以此解答该题.
点评:本题考查无机物的推断,题目难度中等,解答该题的关键是正确推断物质的种类,根据物质的性质解答.

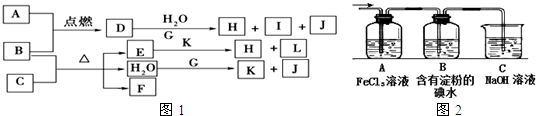
 2Na+Cl2↑,
2Na+Cl2↑, 2Na+Cl2↑,
2Na+Cl2↑,

 (2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成
(2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成