
| 1 | 2 |
| 二氧化碳物质的量 |
| 混合气体总物质的量 |
| 1 |
| 2 |
| 0.5mol |
| 2mol |
| 0.5×0.5 |
| 0.5×0.5 |
| (1-n)×(1-n) |
| n×(1+n) |
| 1 |
| 3 |
1mol-
| ||
| 3mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
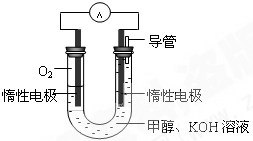 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?武清区三模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2013?武清区三模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:013
在一定温度下,将1mol CO和1 mol水蒸气放在密闭容器中反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到新平衡后,CO2物质的量是
CO2(g)+H2(g),达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到新平衡后,CO2物质的量是
[ ]
|
A.等于0.6mol |
B.等于1mol |
|
C.大于0.6mol,小于1mol |
D.小于1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com