
【题目】下列现象与氢键无关的是( )
A. 小分子的醇、羧酸可以和水以任意比互溶
B. 冰的密度比液态水的密度小
C. 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
D. 水分子是很稳定的分子,加热到很高的温度都难以分解
科目:高中化学 来源: 题型:
【题目】有关苯酚的下列叙述中,错误的是
A. 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶
B. 苯酚是生产电木的单体之一,与甲醛发生缩聚反应
C. 苯酚比苯更易发生苯环上的取代反应
D. 苯酚有毒,也能配制洗涤剂和软药膏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数) ( )
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为3NA
C.12 g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C. 放热反应都不需要加热就能发生
D. 吸热反应在一定条件(如常温、加热等)下也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是_____________(填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是___________(填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
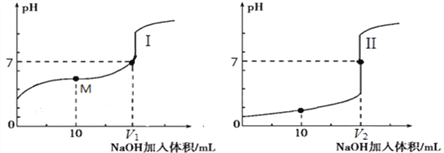
① 滴定醋酸的曲线是____________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________________。
③ V1和V2的关系:V1___________V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________________。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)=_____mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较________(填溶质的化学式)溶液中NH![]() 的浓度更大,其原因是__________________
的浓度更大,其原因是__________________
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料:NaNO2有毒,溶液显碱性,NaNO2有较强的氧化性和较弱的还原性。国家规定肉制品中NaNO2含量不能超过30 mg/kg。
(1)NaNO2溶液显碱性的原因是_____________________。(用离子方程式表达)
活动二:鉴别NaNO2与食盐
(2)可用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是_________。(填化学式)。
活动三:检测熟肉中NaNO2含量的变化
(3)分别从 1000 g刚煮熟的肉和 1000 g隔夜熟肉中提取NaNO2,配成溶液,再分别用0.00500 mol/L酸性高锰酸钾溶液滴定,刚煮熟的肉消耗12.00 mL,隔夜熟肉消耗16.00 mL。(提示:MnO4一转化为Mn2+,NO2一转化为NO3一)
① 在做该滴定实验时需要用到的实验仪器有___________
A.容量瓶 B.酸式滴定管 C.碱式滴定管
D.分液漏斗 E.锥形瓶 F. 烧瓶
② 滴定终点的判断依据为_________________ 。
③隔夜熟肉中NaNO2的含量是____________mg/kg (保留三位有效数字),该数据说明保存得当的隔夜熟肉_________(选填“能”或“不能” )食用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮(C3H60)通常是无色液体,易溶于水,密度小于1g/mL,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,你认为下列方法中最为合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁与同周期的钙性质有很大的差异,铁的熔点更高,而钙的金属活动性更强,这都说明铁的金属键比钙更_____(选填“强”、“弱”)。与钢铁比,纯净的铁有很强的抗腐蚀性,原因是_______________________。氯化铁受热会发生升华现象,这说明氯化铁是______(选填“离子”、“共价”)化合物。
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是______(选填编号)。
FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
(3)FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-形式存在,请完成该反应的化学方程式。__________
____□FeS2+ □Fe2(SO4)3 +□____→ □FeSO4 +□____
(4)溶液的酸碱性对许多物质的氧化性有很大影响;生成物的溶解性会影响复分解反应的方向。将Na2S溶液滴加到FeCl3溶液中,有单质硫生成; 将FeCl3溶液滴加到Na2S溶液中,生成的是Fe2S3而不是S或Fe(OH)3。从以上反应可得出的结论是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com