
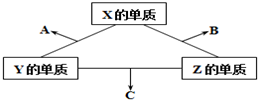
 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
| ||
| 高温高压 |
| ||
| 高温高压 |
| 高温高压 |
| 催化剂 |
| (1mol/L)2 |
| 1mol/L×(1mol/L)3 |


科目:高中化学 来源: 题型:
| A、0.1(2a-b)mol/L |
| B、0.1(b-2a)mol/L |
| C、10(b-2a)mol/L |
| D、10(2a-b)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某未知溶液中滴加足量稀盐酸,再加几滴BaCl2溶液,检验SO42-的存在 |
| B、用100mL量筒量取20.00mL Na2CO3溶液 |
| C、不用另加任何试剂就能鉴别HCl、Na2CO3、Na2SO4 和BaCl2四种无色溶液 |
| D、用粥汤检验淀粉溶液具有丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com