
| A、2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA |
| B、1mol/L的CaCl2溶液中含Cl-的数目为2NA |
| C、常温常压下,1.7gNH3中含N-H键数目为0.3 NA |
| D、标准状况下,11.2 L H2O含有的电子数为5 NA |
| m |
| M |
| m |
| M |
| 1.7g |
| 17g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液中Kw=1×10-14mol2.L-2 |
| C、该NaCl溶液稀释10倍后pH=7 |
| D、该NaCl溶液中Kw=1×10-12mol2.L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④①②⑤③ |
| B、④①②③⑤ |
| C、①④②③⑤ |
| D、①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3:2 |
| B、2:3:3 |
| C、1:3:2 |
| D、3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 L 0.1 mol/L的NH4Cl溶液中NH4+的数目为0.1NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA |
| C、常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
| D、高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3?2H++SO32- |
| B、HF=H++F- |
| C、NaHS=Na++H++S2- |
| D、H2CO3+H2O?H3O++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(C)c(D) |
| c(A)c(B) |
| A、①③⑥ | B、①⑤ |
| C、①④⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
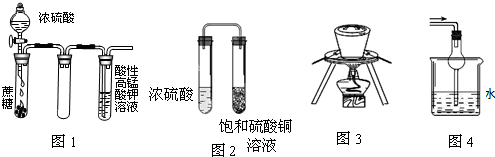
| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com