
| 实验目的 | 实验操作 | |
| A | 除去蛋白质中混有的(NH4)2SO4 | 将混合物装入半透明袋,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有Al粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液中的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.胶体不能透过半透膜,离子可以;
B.Al与NaOH溶液反应,而Mg不能;
C.苯的密度比水的密度小,萃取后有机层在上层;
D.NaClO溶液具有漂白性.
解答 解:A.胶体不能透过半透膜,离子可以,则将混合物装入半透明袋,并放入流动的蒸馏水中可分离,故A正确;
B.Al与NaOH溶液反应,而Mg不能,则加入足量NaOH溶液,过滤、洗涤、干燥可分离,故B正确;
C.苯的密度比水的密度小,萃取后有机层在上层,则先从分液漏斗下口放出水层,再从上口倒出有机层,故C正确;
D.NaClO溶液具有漂白性,不能使用pH试纸测定pH,应选pH计,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、pH测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
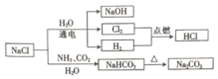
| A. | NaHCO3的热稳定性较好 | |
| B. | H2与Cl2反应时产生苍白色火焰 | |
| C. | NaOH俗称纯碱 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
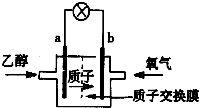 (1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O
(1)最新研制的一种新型乙醇电池示意图如图,电池的两极分别充入乙醇和氧气,用酸类离子作溶剂.则电池工作时a (选填a或b)为负极,b极的电极反应式为O2+4H++4e-=2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③⑤① | B. | ①②③⑤ | C. | ④⑥③① | D. | ④③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm | |
| B. | Fe(OH)3胶体带正电 | |
| C. | 往Fe(OH)3胶体中逐滴滴入硫酸溶液,现象是:先有红褐色沉淀后沉淀溶解 | |
| D. | Fe(OH)3胶体能够吸附水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ρ=$\frac{(36.5V+22400)c}{V}$ | B. | c=$\frac{1000Vρ}{36.5V+22400}$ | ||
| C. | V=$\frac{22400ω}{36.5(1-ω)}$ | D. | ρ=$\frac{36.5c}{1000ω}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,则该溶液中一定含有钾离子 | |
| B. | 向某溶液中滴加足量稀盐酸,产生的气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 如果在蒸馏实验中忘记加沸石,可以先停止加热,待溶液冷却后补加沸石,再继续加热蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com