
分析 一定体积的HCl气体,将其溶于100mL稀硫酸中,向混合溶液中加入氢氧化钠溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,恰好呈中性,溶液中溶质为Na2SO4 、NaCl,再向中和后的溶液中加过量的Ba(OH)2溶液,发生反应SO42-+Ba2+=BaSO4 ↓,所得沉淀质量为2.33g为BaSO4的质量,根据硫酸钡的质量,利用硫酸根守恒计算计算硫酸的物质的量,根据c=$\frac{n}{V}$计算硫酸的物质的量浓度,进而计算硫酸反应的氢氧化钠的物质的量,计算与盐酸反应的氢氧化钠的物质的量,再根据方程式计算HCl的物质的量,由此分析解答.
解答 解:(1)2.33gBaSO4的物质的量为:n=$\frac{m}{M}$=$\frac{2.33g}{233g/mol}$=0.01mol,根据硫酸根守恒n(H2SO4)=n(BaSO4)=0.01mol,所以硫酸的物质的量浓度为$\frac{0.01mol}{0.1L}$=0.1mol/L;
故答案为:0.1mol/L;
(2)根据方程式H2SO4+2NaOH=Na2SO4 +2H2O可知,以0.01mol硫酸反应需要氢氧化钠的物质的量为0.01mol×2=0.02mol,故与盐酸反应氢氧化钠的物质的量为:0.01L×4mol/L-0.02mol=0.02mol,
由方程式HCl+NaOH=NaCl+H2O可知,n(HCl)=n(NaOH)=0.02mol,V=n×Vm=0.02mol×22.4mol/L=0.448L=448mL,
故答案为:448;
(3)向混合溶液中加入氢氧化钠溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HCl+NaOH=NaCl+H2O,恰好呈中性,n(H+)=n(OH-)=0.04mol,加入Na2CO3•10H2O晶体,发生反应CO32-+2H+═CO2↑+H2O,n(Na2CO3•10H2O)=n(CO32-)=$\frac{1}{2}$n(H+)=0.02mol,所以m(Na2CO3•10H2O)=nM=0.02mol×286g/mol=5.72g,
故答案为:5.72.
点评 本题考查根据方程式的计算,题目难度中等,清楚反应过程是解题的关键,注意守恒思想的运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
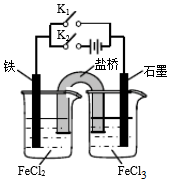
| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若实验室发生火灾,应立即打开门窗(或排风扇)通风透气 | |
| B. | 实验结束后,用嘴吹熄酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断的搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com