
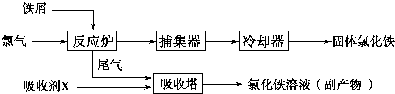
���� �������з�Ӧ���̣��ڷ�Ӧ¯������������Ӧ�����Ȼ������ڲ��������ռ�����ȴ�������Ȼ������ӷ�Ӧ¯�г�����β����Ҫ�������������ռ����պ���Ȼ�����Һ���������ռ�XӦ���Ȼ�������
��1���Ȼ�����ˮ����ˮ�����������������壬Fe��OH��3����������������ˮ�����������ʣ�
��2��β���к��й����������������Ȼ����������ɹ������̿�֪������ˮ��X�������������������������Ȼ������������ռ�XΪ�Ȼ�������ͬʱ�ܽ��Ȼ���������
��3��������Feԭ����Clԭ����Ŀ֮��Ϊ1��3����������Ϊ��FeCl3��n��������Է�����������nֵ��ȷ�����ʵķ���ʽ��
��4��FeCl3 ��Һ�У��¶�Խ���Ȼ������ܽ��Խ�ߣ�����Һ��þ����������������ȴ���壬��������ˮ��Ӧ�ȼ������������
��5����FeCl3 ��Һ��32%��35%����ʴӡˢ��·��ķ�Һ�к�FeCl3��FeCl2 ��CuCl2������ͭ��������Һ�м�����������ۣ���ͭ�û����������������ȥ���������ɵ�ͭ��
��� �⣺�������з�Ӧ���̣��ڷ�Ӧ¯������������Ӧ�����Ȼ������ڲ��������ռ�����ȴ�������Ȼ������ӷ�Ӧ¯�г�����β����Ҫ�������������ռ����պ���Ȼ�����Һ���������ռ�XӦ���Ȼ�������
��1���Ȼ�����ˮ����ˮ�����������������壬�ù��̿������ӷ���ʽΪ��Fe3++3H2O=Fe��OH��3�����壩+3H+��Fe��OH��3����������������ˮ�����������ʣ�
�ʴ�Ϊ��Fe3++3H2O=Fe��OH��3�����壩+3H+��Fe��OH��3����������������ˮ�����������ʣ�
��2��β���к��й����������������Ȼ����������ɹ������̿�֪������ˮ��X�������������������������Ȼ������������ռ�XΪ�Ȼ�������ͬʱ�ܽ��Ȼ���������
�ʴ�Ϊ��FeCl2��Һ��
��3��������Feԭ����Clԭ����Ŀ֮��Ϊ1��3����������Ϊ��FeCl3��n���÷�����Է�������Ϊ325����
��56+35.5��3����n=325����ã�n=2�����Ը����ʵķ���ʽΪFe2Cl6��
�ʴ�Ϊ��Fe2Cl6��
��4��FeCl3 ��Һ�У��¶�Խ���Ȼ������ܽ��Խ�ߣ�����Һ��þ����������������ȴ���壮Fe3+��ˮ��Ӧ�ȼ������������ᣬ����Fe3+ˮ�⣬������������ȴ������FeCl3•6H2O��
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��5����FeCl3 ��Һ��ʴӡˢ��·��ķ�Һ�к�FeCl3��FeCl2 ��CuCl2������ͭ��������Һ�м�����������ۣ���ͭ�û����������������ȥ���������ɵ�ͭ���������Ϊ�ӹ������ۣ�������ӦCuCl2+Fe�TFeCl2+Cu�����ˣ�����õ��Ĺ����������ᷴӦ���ܽ�������������˵õ�ͭ��
�ʴ�Ϊ���ӹ������ۣ�������ӦCuCl2+Fe�TFeCl2+Cu�����ˣ�����õ��Ĺ����������ᷴӦ���ܽ�������������˵õ�ͭ��
���� ���⿼��ѧ���Թ������̵����⡢���ʵķ����ᴿ�Ȼ���������������ԭ��Ӧ�ζ�Ӧ�á��ܶȻ��йؼ���ȣ��Ѷ��еȣ���Ҫѧ��������ʵ�Ļ���֪ʶ���������֪ʶ��������������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���ʣ����ʣ� | �Լ� |
| A | ʳ�Σ�ϸɳ�� | NaOH��Һ |
| B | CO��NH3�� | ŨH2SO4 |
| C | CO2��SO2�� | Na2CO3��Һ |
| D | NaHCO3��Һ��Na2CO3�� | Ca��OH��2��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | �۵�/�� | �е�/�� |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Na2S2O3�׳ƴ��մ���������Ҫ�Ļ���ԭ�ϣ���Na2SO3�������ˮ��Һ�м��ȷ�Ӧ�������Ƶ�Na2S2O3����֪10���70��ʱ��Na2S2O3��100gˮ�е��ܽ�ȷֱ�Ϊ60.0g��212g�������£�����Һ�������ľ�����Na2S2O3•5H2O����ʵ��������ȡNa2S2O3•5H2O���壨Na2S2O3•5H2O�ķ�����Ϊ248���������£�
Na2S2O3�׳ƴ��մ���������Ҫ�Ļ���ԭ�ϣ���Na2SO3�������ˮ��Һ�м��ȷ�Ӧ�������Ƶ�Na2S2O3����֪10���70��ʱ��Na2S2O3��100gˮ�е��ܽ�ȷֱ�Ϊ60.0g��212g�������£�����Һ�������ľ�����Na2S2O3•5H2O����ʵ��������ȡNa2S2O3•5H2O���壨Na2S2O3•5H2O�ķ�����Ϊ248���������£�| �ζ����� | �ζ�ǰ������mL�� | �ζ��ζ��������mL�� |
| ��һ�� | 0.30 | 31.12 |
| �ڶ��� | 0.36 | 31.56 |
| ������ | 1.10 | 31.88 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Һ������ɫ��30s�ڲ���ɫ
��Һ������ɫ��30s�ڲ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij̽��С��Ϊ̽�����������ʣ�����װ��F��ȡ������Ư��Һ�������������ʵ��װ�ã���ش��������⣺
ij̽��С��Ϊ̽�����������ʣ�����װ��F��ȡ������Ư��Һ�������������ʵ��װ�ã���ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com