
ЎѕМвДїЎїПЦУРє¬FeCl2ФУЦКµДВИ»ЇНѕ§МеЈЁCuCl22H2OЈ©Ј¬ОЄЦЖИЎґїѕ»µДCuCl22H2OЈ¬КЧПИЅ«ЖдЦЖіЙЛ®ИЬТєЈ¬И»єу°ґПВНјЛщКѕІЅЦиЅшРРМбґїЈє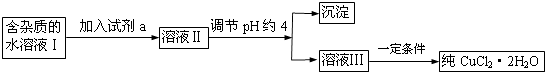
25ЎжІї·ЦСфАлЧУТФЗвСх»ЇОпРОКЅНкИ«іБµнК±ИЬТєµДpHјыПВ±нЈє
іБµнОп | FeЈЁOHЈ©3 | FeЈЁOHЈ©2 | CuЈЁOHЈ©2 |
їЄКјіБµнpH | 2.7 | 7.6 | 4.7 |
НкіЙіБµнpH | 3.2 | 9.7 | 6.7 |
Зл»ШґрПВБРОКМвЈє
ЈЁ1Ј©БчіМЦРјУИлµДКФјБaЧоєПККµДКЗЈЁМоРтєЕЈ©AЈ®ЛбРФёЯГМЛбјШИЬТє BЈ®NaClOИЬТєCЈ®H2O2ИЬТє DЈ®ПЎПхЛб
јУИлКФјБaµДДїµДКЗ Ј®
ЈЁ2Ј©µчЅЪpHФј4У¦ёГјУИлµДОпЦКїЙТФКЗ Ј®
A.CuO
B.CuCl2
C.CuЈЁOHЈ©2
D.NaOH
ЈЁ3Ј©ЧоєуДЬІ»ДЬЦ±ЅУХф·ўЅбѕ§µГµЅCuCl22H2OЈїЈЁМоЎ°ДЬЎ±»тЎ°І»ДЬЎ±Ј©Ј®
Ўѕґр°ёЎї
ЈЁ1Ј©CЈ»Ѕ«Fe2+Сх»Ї
ЈЁ2Ј©AC
ЈЁ3Ј©І»ДЬ
ЎѕЅвОцЎїЅвЈєЦЖИЎґїѕ»µДCuCl22H2OЈ¬УЙБчіМїЙЦЄЈ¬јУИлaОЄСх»ЇјБїЙСх»ЇСЗМъАлЧУЈ¬µ«І»ДЬТэИлРВФУЦКЈ¬ФтaОЄH2O2ИЬТєЈ¬µчЅЪpHФЪ3.2ЈјpHЈј4.4К№МъАлЧУЧЄ»ЇОЄіБµнЈ¬И»єу№эВЛЈ¬ВЛТєФЪHClЖшБчЦРХф·ўЅбѕ§µГµЅCuCl22H2OЈ¬ЈЁ1Ј©БчіМЦРјУИлµДКФјБaЧоєПККµДКЗCЈ¬ЖдДїµДКЗЅ«Fe2+Сх»ЇЈ¬ЛщТФґр°ёКЗЈєCЈ»Ѕ«Fe2+Сх»ЇЈ»ЈЁ2Ј©Сх»ЇНЎўЗвСх»ЇНѕщїЙґЩЅшМъАлЧУЛ®ЅвЧЄ»ЇОЄіБµнЈ¬ВИ»ЇНІ»ДЬЈ¬¶шNaOHУл¶юХЯѕщ·ґУ¦І»ДЬіэФУЈ¬ЛщТФґр°ёКЗЈєACЈ»ЈЁ3Ј©ТтјУИИґЩЅшНАлЧУЛ®ЅвЈ¬ЙъіЙµДHClТЧ»У·ўЈ¬ФтІ»ДЬЦ±ЅУХф·ўЅбѕ§µГµЅCuCl22H2OЈ¬ЛщТФґр°ёКЗЈєІ»ДЬЈ®



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЎ¶ЬФАт»ЁЎ·КЗТ»КЧлЪЦЛИЛїЪµДЅЛХГсёиЎЈЬФАт»ЁПгЖшµДіЙ·ЦУР¶аЦЦЈ¬ТТЛб±ЅјЧхҐ(![]() )КЗЖдЦРµДТ»ЦЦЈ¬ЛьїЙТФґУЬФАт»ЁЦРМбИЎЈ¬ТІїЙТФУГјЧ±ЅєНТТґјОЄФБПЅшРРИЛ№¤єПіЙЎЈТ»ЦЦєПіЙВ·ПЯИзПВЈє
)КЗЖдЦРµДТ»ЦЦЈ¬ЛьїЙТФґУЬФАт»ЁЦРМбИЎЈ¬ТІїЙТФУГјЧ±ЅєНТТґјОЄФБПЅшРРИЛ№¤єПіЙЎЈТ»ЦЦєПіЙВ·ПЯИзПВЈє
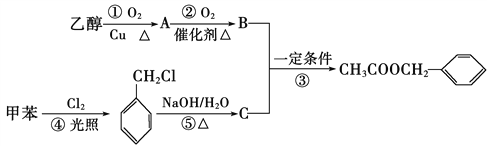
ЈЁ1Ј©BЎўCµДЅб№№јтКЅ·Ц±рОЄ________Ўў________ЎЈ
ЈЁ2Ј©Рґіц·ґУ¦ўЩЎўўЫЎўўЬµД»ЇС§·ЅіМКЅЈє
ўЩ______________________________________________________________Ј»
ўЬ______________________________________________________________ЎЈ
ўЫ______________________________________________________________Ј»
ЈЁ3Ј©·ґУ¦ўЩЎўўЫЎўўЬЎўўЭµД·ґУ¦АаРН·Ц±рОЄўЩ______ўЫ______Ј¬ўЬ_____Ј¬ўЭ_____ЎЈ
ЈЁ4Ј©·ґУ¦______(МоРтєЕ)ФЧУµДАнВЫАыУГВКОЄ100%Ј¬·ыєПЎ°ВМЙ«»ЇС§Ў±µДТЄЗуЎЈ
ЈЁ5Ј©AЦР№ЩДЬНЕµДГыіЖКЗ___________Ј¬јмСйХвЦЦ№ЩДЬНЕіэБЛїЙТФУГТш°±ИЬТє»№їЙТФУГ______ЈЁМоГыіЖЈ©
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБР»ЇС§КЅЦ»ґъ±нТ»ЦЦОпЦК·ЦЧУµДКЗ( )
A.SiO2B.C8H10C.C3H8D.C4H8
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРИЬТєТ»¶ЁПФЛбРФµДКЗЈЁЎЎЎЎЈ©
A.є¬H+µДИЬТє
B.pH=6µДИЬТє
C.cЈЁOH©ЃЈ©ЈјcЈЁH+Ј©µДИЬТє
D.ДЬУлAlЈЁOHЈ©3·ґУ¦µДИЬТє
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї¶ФУЪИхЛбЈ¬ФЪТ»¶ЁОВ¶ИПВґпµЅµзАлЖЅєвК±Ј¬ёчОўБЈµДЕЁ¶ИґжФЪТ»ЦЦ¶ЁБїµД№ШПµЈ®ПВ±нОЄјёЦЦИхЛбФЪ25ЎжК±µДµзАлЖЅєвіЈКэ
Лб | µзАлЖЅєвіЈКэK |
CH3COOH | 1.76ЎБ10©Ѓ5 |
H2CO3 | K1=4.3ЎБ10©Ѓ7 K2=5.61ЎБ10©Ѓ11 |
H3PO4 | K1=7.52ЎБ10©Ѓ3 K2=6.23ЎБ10©Ѓ8 K3=2.20ЎБ10©Ѓ13 |
»ШґрПВБРОКМвЈє
ЈЁ1Ј©ґУµзАлµДЅЗ¶ИЈ¬HCO ![]() ЎўHPO
ЎўHPO ![]() ЎўH2PO4©Ѓ¶јїЙїґЧчКЗЛбЈ¬ЖдЦРЛбРФЧоЗїµДКЗ Ј¬ ЧоИхµДКЗ Ј®
ЎўH2PO4©Ѓ¶јїЙїґЧчКЗЛбЈ¬ЖдЦРЛбРФЧоЗїµДКЗ Ј¬ ЧоИхµДКЗ Ј®
ЈЁ2Ј©µзАлЖЅєвіЈКэКЗУГКµСйµД·Ѕ·ЁІв¶ЁіцАґµДЈ®ПЦТСѕІвµГ25ЎжК±Ј¬c mol/LµДCH3COOHµДµзАлЧЄ»ЇВКОЄaЈ¬ФтёГОВ¶ИПВґЧЛбµДµзАлЖЅєвіЈКэKCH3COOH= Ј®
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРХэИ·µДКЗЈЁ Ј©
A.МјЛбµДµзАлЈєH2CO3?H++HCO ![]()
B.Бт»ЇДЖЛ®ЅвЈєS2©Ѓ+2H2O?H2SЎь+2OH©Ѓ
C.Na2CO3ИЬТєЦРЈєcЈЁHCO ![]() Ј©ЈѕcЈЁOH©ЃЈ©
Ј©ЈѕcЈЁOH©ЃЈ©
D.NH4ClИЬТєЦРЈ¬cЈЁNH ![]() Ј©ЈѕcЈЁCl©ЃЈ©
Ј©ЈѕcЈЁCl©ЃЈ©
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїHgCl2µДПЎИЬТєїЙУГЧчКЦКхµ¶µДПы¶ѕјБЈ¬ТСЦЄИЫИЪµДHgCl2І»µјµзЈ¬¶шHgCl2µДПЎИЬТєУРИхµДµјµзДЬБ¦Ј¬ПВБР№ШУЪHgCl2µДРрКцХэИ·µДКЗЈЁЎЎЎЎЈ©
A.HgCl2КфУЪАлЧУ»ЇєПОп
B.HgCl2КфУЪ№ІјЫ»ЇєПОп
C.HgCl2КфУЪ·ЗµзЅвЦК
D.HgCl2КЗИхЛбИхјоСО
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУГРїЖ¬Ул1 molЎ¤LЈ1ПЎСОЛб·ґУ¦ЦЖИЎЗвЖшК±Ј¬ПВБРґлК©І»ДЬК№ЗвЖшЙъіЙЛЩВКФцґуµДКЗ
A.¶ФёГ·ґУ¦МеПµјУИИ
B.јУИлЙЩБїNaClИЬТє
C.І»УГРїЖ¬Ј¬ёДУГРї·Ы
D.јУИлЙЩБї1 molЎ¤LЈ1БтЛб
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїОЄФцЗїВБµДДНёЇКґРФЈ¬ПЦТФЗ¦РоµзіШОЄНвµзФґЈ¬ТФAlЧчСфј«ЎўPbЧчТхј«Ј¬µзЅвПЎБтЛбЈ¬К№ВБ±нГжµДСх»ЇД¤ФцєсЈ®Жд·ґУ¦ФАнИзПВЈєµзіШЈєPbЈЁsЈ©+PbO2ЈЁsЈ©+2H2SO4ЈЁaqЈ©=2PbSO4ЈЁsЈ©+2H2OЈЁlЈ©Ј»µзЅвіШЈє2Al+3H2O ![]() Al2O3+3H2ЎьЈ¬µзЅв№эіМЦРЈ¬ТФПВЕР¶ПХэИ·µДКЗЈЁ Ј©
Al2O3+3H2ЎьЈ¬µзЅв№эіМЦРЈ¬ТФПВЕР¶ПХэИ·µДКЗЈЁ Ј©
µзіШ | µзЅвіШ | |
A | H+ТЖПтPbµзј« | H+ТЖПтPbµзј« |
B | ГїПыєД3molPb | ЙъіЙ2molAl2O3 |
C | Хэј«ЈєPbO2+4H++2e©Ѓ=Pb2++2H2O | Сфј«Јє2Al+3H2O©Ѓ6e©Ѓ=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com