
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液pH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中pH值增大,有O2放出 |
分析 过氧化钠与水反应生成NaOH和O2,消耗水,溶液有NaOH晶体析出,反应后仍为饱和溶液,温度一定,氢氧化钠溶液浓度不变,由于溶剂的质量减少,则饱和溶液中的溶质的物质的量减小,据此分析.
解答 解:过氧化钠与水反应生成NaOH和氧气,该反应为2Na2O2+2H2O=4NaOH+O2↑,因为已经饱和,所以不会再溶解,浓度不变,但由于水的减少,水中Na+、OH-的数目减少.
A.溶液中Na+浓度不变,有O2放出,故A错误;
B.原饱和溶液有晶体析出,剩余溶液还是饱和溶液,温度不变时,溶液中离子的浓度不变,溶液中OH-浓度不变,溶液中H+浓度也不变,即溶液pH值不变,有O2放出,故B错误;
C.浓度不变,但由于水的减少,水中Na+、OH-的数目减少,有O2放出,故C正确;
D.有O2放出,溶液中OH-浓度不变,溶液中H+浓度也不变,即溶液pH值不变,故D错误;
故选C.
点评 本题考查钠的重要化合物,侧重于化学知识的综合应用的考查,注意把握饱和溶液的性质,学习中注意相关基础知识的积累,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 第2min时,c(Fe2+)=0.01 mol•L-1 | |
| B. | 混合溶液中,c(K+)=0.01 mol•L-1 | |
| C. | 0~2min内,v(I-)=0.01 mol•L-1•min-1 | |
| D. | 第2min时,c(Fe3+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若pH>7时,则一定是C1V1>C2V2 | |
| B. | 若pH<7时,混合溶液中可能有c(Na+)>c(H+) | |
| C. | 当pH=7时,若V1=V2,则一定是C2=C1 | |
| D. | 若 V1=V2,C1=C2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 用NaOH标准溶液滴定醋酸溶液至中性时,醋酸则被完全中和 | |
| C. | 将Na2S2O3溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
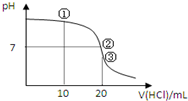 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )| A. | ①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)>c(C1-)>c(OH-)=c(H+) | |
| C. | ③溶液:c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| B. | 乙酸乙酯的制备实验中,饱和Na2CO3溶液不仅可以降低乙酸乙酯的溶解度,还能吸收挥发出来的乙醇及乙酸 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
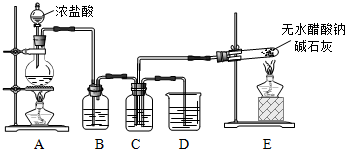
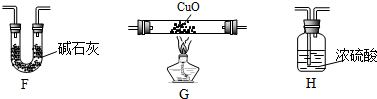
| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷转化为白磷,属于物理变化 | |
| B. | 石墨导电、金刚石不导电,故二者不是同素异形体 | |
| C. | O2和O3分子式不同,结构相同 | |
| D. | 单质硫有S2、S4、S6等,它们都是硫的同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com