
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.常温下,56 g铁片投入足量浓H2SO4溶液中生成NA个SO2分子
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.50℃时,1.0 L pH=1的H2SO4 溶液中含有的H+数目为0.1NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强 碱与强酸的体积比是( ).
碱与强酸的体积比是( ).
A.11∶1 B.9∶1 C.1∶11 D.1∶9
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)= c(CH3C OO-)+ c(OH-)
OO-)+ c(OH-)
B.加入少量CH3COONa固体后,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
下列物质的稀溶液中存在电离平衡的有(不考虑水的电离) ( )
A. NaHCO3 B. NaHSO4 C. NH4NO3 D. HBr
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学试卷(解析版) 题型:选择题
25℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
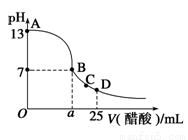
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.Ka(CH3COOH)=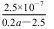
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:实验题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
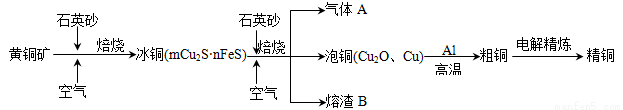
(1)气体A中的大气污染物可选用下列试剂中的 吸收。(双选))
a . 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a. 电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+ 2H2SO4 
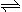 2 CuSO4 + 2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
2 CuSO4 + 2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:选择题
在一定温度下,固定体积为2L密闭容器中,发生反应:
2SO2(g)+O2(g)  2SO3(g ) ΔH <0,n(SO2)随时
2SO3(g ) ΔH <0,n(SO2)随时 间的变化如表:
间的变化如表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是( )
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4 min 内该反应的平均速率为0.005 mol/(L·min)
内该反应的平均速率为0.005 mol/(L·min)
C. 平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
D.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:选择题
为了检验某固体物质中是否含有NH,下列试纸和试剂一定用不到的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤ B.④⑤
C.①③ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
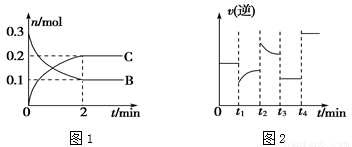
下列有关说法正确的是( )
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com