
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起 到重要作用。
到重要作用。
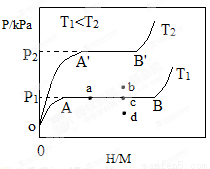
(1)一定温度下,某贮氢 合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MH与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)
合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MH与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g) zMHy(s) △H1(I);B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。
zMHy(s) △H1(I);B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。
反应(I)的焓变△HⅠ_______0(填“>”“<”或“=”)。
反应(I)中z=___________(用含x和y的代数式表示)。
温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=________mL•g?1•min?1。
(2)当反应(I)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的_______点(填“b”“c”或“d”),该贮氢合金可通过______或_______的 方式释放氢气。η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)___ _______η(T2)(填“>”“<”或“=”)。
方式释放氢气。η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)___ _______η(T2)(填“>”“<”或“=”)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年辽宁师大附中高二12月月考化学试卷(解析版) 题型:选择题
为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
物质 | 试剂 | 分离方法 | |
① | 硝酸钾( | 蒸馏水 | 降温、结晶、过滤 |
② | 二氧化碳(氯化氢) | 饱和碳酸钠 | 洗气 |
③ | 苯(苯酚) | 饱和碳酸钠 | 蒸馏 |
④ | 苯(甲苯) | 浓溴水 | 分液 |
A.①② B.①③ C.只有③ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第二次考试化学卷(解析版) 题型:选择题
将金属钠投入下列物质的溶液中,有气体放出,且溶液质量减轻的是
①稀盐酸 ②K2SO4溶液 ③CuSO4溶液 ④饱和NaOH溶液.
A.④ B.③ C.③④ D.①②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
在一定温度下,有A.盐酸 b.硫酸 c.醋酸三种酸,下列说法正确的是( )
A.等物质的量浓度的三种酸的pH由大到小的关系为b>a>c
B.等物质的量浓度等体积的三种酸,与等浓度的NaOH溶液反应,消耗碱的体积 由大到小的顺序是a=b=c
由大到小的顺序是a=b=c
C.三者pH相同、体积相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是c>a=b
D.三者pH相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则三者的初始反应速率大小关系为b >a>c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第二次考试化学卷(解析版) 题型:选择题
根据下列有关图象,说法正确的是( )
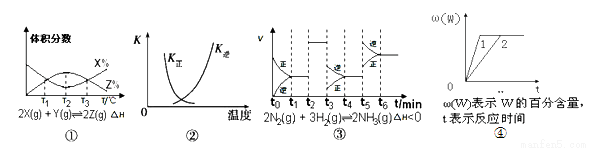
A. 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 图②中曲线表示反应2SO2(g)+O2(g)  2SO3(g),ΔH<0的正、逆反应平衡常数K随温度的变化
2SO3(g),ΔH<0的正、逆反应平衡常数K随温度的变化
C. 由图③知,反应在t6时,NH3体积分数最大。
D. 其他条件不变时,图④中曲线表示不同压强对反应aX(g)+bY(s) nW(g)的影响,且P1>P2,n=a+b。
nW(g)的影响,且P1>P2,n=a+b。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考三化学卷(解析版) 题型:选择题
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
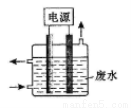
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e?=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e?=H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考三化学卷(解析版) 题型:选择题
由乙炔为原料制取CHClBr-CH2Br,下列方法中,最可行的是
A.先与HBr加成后,再与HCl加成
B.先与H2完 全加成后,再与Cl2、Br2取代
全加成后,再与Cl2、Br2取代
C.先与HCl加成后,再与Br2加成
D.先与Cl2加成后,再与 HBr加成
HBr加成
查看答案和解析>>
科目:高中化学 来源:2017届湖南师大附中高三上月考四化学试卷(解析版) 题型:选择题
pH=1的HA、HB两溶液各10 mL,分别加水稀释至1000 mL,其pH变化关系如图所示,下
列说法正确的是
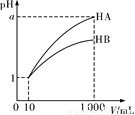
A.HA一定是强酸,HB一定是弱酸
B.稀释后,HA溶液的酸性比HB溶液的酸性弱
C.向上述10 mL HA溶液中加入10 mL pH=13的NaOH溶液,溶液中有 c(Na+)>c(A-)>c(OH-)>c(H+)
D.当a=3时,HA、HB两溶液起始浓度相等
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江哈尔滨三中高三上验收考试三化学卷(解析版) 题型:填空题
A、B、C、D、E、F、G和J是元素周期表中前20号的主族元素,其原子序数依次增大。已知:
①A和D为同主族元素,且A的单质是最轻的气体;
②B元素最高价氧化物的水化物与其气态氢化物反应生成盐;
③F、G相邻,C的核电荷数是F核外电子数的一半,F与J可形成离子化合物J2F;
④E元素是地壳中含量最多的金属元素。
完成下列填空:
(1)ACD三种元素共同形成的化合物的电子式为____________,其微粒间存在的化学键有____________;将这种化合物滴入EG两种元素形成的化合物溶液中,直至过量,总反应的离子方程式为__________________。
(2)E元素位于周期表的第____________周期____________族。
(3)铜与B元素最高价氧化物的水化物的浓溶液反应的离子方程式为_________________。
(4)F、G分别与A形成的化合物,还原性强的是_______(填写相应的化学式)。
(5)F简单阴离子的结构示意图_______,且F、G、J简单离子的半径由大至小的顺序是_______(填写相应离子符号)
(6)实验室制取单质G的化学方程式为____________________________,
比较F、G的最高价氧化物的水化物的酸性(填写相应化学式)_______>_______。
(7)一种燃料电池,以铂为电极插入KOH溶液中,分别向两极通入A单质和C单质。通入C单质的一极是_______极,电极反应式为:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com