
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
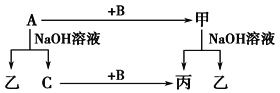
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
【答案】 Al O2 Al2O3 NaAlO2 2Al+2NaOH+2H2O===2 NaAlO2+3H2 ↑ Al2O3+2OH-=== 2AlO2-+H2O 0.1mol 0.3mol。
【解析】试题分析:本题考查无机推断,主要考查Al及其化合物的相互转化,化学方程式和离子方程式的书写,化学计算。A是金属单质,A能与NaOH溶液反应,金属单质能与NaOH溶液反应的为Al,则A为Al;Al与NaOH溶液反应生成NaAlO2和H2,C是单质,C为H2,乙为NaAlO2;B是单质,Al+B→甲,甲+NaOH→丙+NaAlO2,H2+B→丙,则B为O2,甲为Al2O3,丙为H2O。
(1)A的化学式为Al,B的化学式为O2,甲的化学式为Al2O3,乙的化学式为NaAlO2。
(2)①Al与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
②Al2O3与NaOH溶液反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(3)n(H2)=![]() =0.15mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(Al)=
=0.15mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(Al)=![]() n(H2)=
n(H2)=![]() 0.15mol=0.1mol;反应消耗1molAl转移3mol电子,则该反应中转移电子物质的量为0.3mol。
0.15mol=0.1mol;反应消耗1molAl转移3mol电子,则该反应中转移电子物质的量为0.3mol。


科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )。
A. 950 mL 111.2 g B. 500 mL 117 g
C. 1 000 mL 117 g D. 任意规格 111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含H+的溶液一定呈酸性
B.pH=7的溶液一定呈中性
C.c(OH﹣)═c(H+)的溶液一定呈中性
D.水中加入硫酸恢复至室温后,Kw=c(H+)c(OH﹣)将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素检验可用以下步骤完成,各步骤选用实验用品不能都用到的( ) 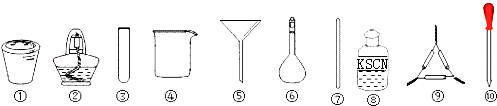
A.将茶叶灼烧灰化,选用①、②和⑨
B.过滤得到滤液,选用④、⑤和⑦
C.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
D.检验滤液中的Fe3+ , 选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某学生学完化学用语后的一次练习的部分内容,其中不正确的是
A.2MnO42-:表示2个高锰酸根离子
B.维生素C(C6H8O6):表示该物质由三种元素组成,每个分子中含20个原子
C.Ar:可表示1个氩分子由1个氩原子构成
D.2O:表示2个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,下列对所得溶液的描述不正确的是( )
A.
当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图变化关系
B.当a=b时,所得溶液中存在:c(OH﹣)+c(CO32﹣)=c(H+)+c(H2CO3)
C.当2a=b时,所得溶液中存在:c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
D.当 ![]() <a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
<a/b<1时,所得溶液中一定存在:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
I.工业生产纯碱的工艺流程示意图如下:

(1)为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是________。
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是________________。
(3)碳酸化后过滤,滤液A最主要的成分是______________(填写化学式),检验这一成分的阴离子的具体方法是:________________________________。
(4)煅烧制取Na2CO3在_______(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
II.纯碱在生产生活中有广泛的用途。
(5)工业上,可能用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为________________________。
(6)纯碱可制备重铬酸钠(Na2Cr2O7),铬铁矿中的1molCr2O3反应时需要通入标准状况下O2的体积为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1mol X(g)和2mol Y(g)发生反应:X(g)+mY (g)3Z(g)△H<0,平衡时,X和Y的转化率都是10%.下列叙述不正确的是( )
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com