
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ | |
| D. | AgNO3溶液中加入过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
分析 A.乙二酸为弱酸应保留化学式;
B.铵根离子、氢离子与少量氢氧根离子反应,先发生酸碱的中和反应;
C.二者发生氧化还原反应,VO2+被氧化为VO2+,高锰酸根离子被还原;
D.不符合反应客观事实,氨水过量,反应生成可溶性络合物.
解答 解:A.高锰酸钾溶液与乙二酸(草酸)发生氧化还原反应,乙二酸被氧化生成二氧化碳,高锰酸根离子被还原为二价锰离子,离子方程式:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,故A错误;
B.在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液,离子方程式:H++OH-═H2O,故B错误;
C.二者发生氧化还原反应,VO2+被氧化为VO2+,高锰酸根离子被还原,离子方程式:5VO2++MnO4-+H2O═5VO2++Mn2++2H+,故C正确;
D.向AgNO3溶液中滴加氨水至过量,AgOH可溶于过量氨水,正确的应为:Ag++3NH3•H2O═[Ag(NH3)2]++OH-+NH4++2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确物质的性质及发生反应的实质是解题关键,注意氧化还原反应应遵循得失电子守恒规律,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨与O2反应 | B. | 硫磺与O2反应 | ||
| C. | 闪电时,氮气与O2反应 | D. | 硅在足量的O2中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与Na2S03溶液加足量稀HNO3 | |
| B. | Ba(0H)2溶液与KN03溶液加足量稀H2SO4 | |
| C. | AgN03溶液与Na2C03溶液加足量稀盐酸 | |
| D. | Ca(0H)2溶液与FeCl3溶液加足量稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向亚磷酸溶液中加入过量的烧碱溶液(亚磷酸是二元弱酸):H3PO3+3OH-═PO33-+3H2O | |
| B. | 2mol•L-1的AlCl3溶液和7mol•L-1的NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 用硝酸酸化的硝酸铁溶液可以刻蚀银饰:Fe3++Ag═Fe2++Ag+ | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
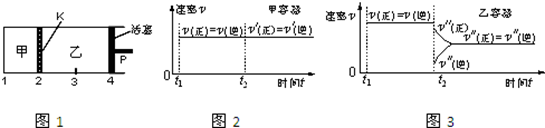
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com