
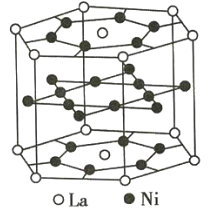
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )
A.LaNi5B.LaNiC.La14Ni24D.La7Ni12
【答案】A
【解析】
六方晶胞原子均摊规则为:(1)每个顶点上的粒子被6个晶胞共用;(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用;(3)每个面心上的粒子被2个晶胞共用;(4)晶胞内的粒子完全属于该晶胞;该基本结构单元为六方晶胞,La原子处于晶胞顶点与面心上,顶点上La原子为6个晶胞共用,面心上的La原子为2个晶胞共用,Ni原子处于晶胞内部和面上,晶胞内部的La原子为一个晶胞独有,面上的La原子为2个晶胞共用,根据均摊法计算晶胞中La和Ni原子数目,再根据原子数目之比确定化学式,据此计算解答。
镧(La)镍(Ni)合金是一种储氢材料,根据其基本结构单元示意图可知,该结构单元中含La原子数为12×![]() +2×
+2×![]() =3,含有Ni的原子数为18×
=3,含有Ni的原子数为18×![]() +6=15,则La和Ni的原子数比为3:15=1:5,该合金的化学式可表示为LaNi5,故合理选项是A。
+6=15,则La和Ni的原子数比为3:15=1:5,该合金的化学式可表示为LaNi5,故合理选项是A。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】铁、铝、铜三种金属元素在日常生活中的应用最为广泛。回答下列问题:
(1)基态Fe原子的简化电子排布式为__________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式_________;Fe(CO)5分子中σ键与π键之比为_______。
(3)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_______。NO3-中心原子的轨道杂化类型为________。
②与NH3互为等电子体的一种阴离子为_______(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因________。
(4)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
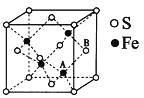
(5)铁和硫形成的某种晶胞结构如图所示,晶胞参数a=xpm,则该物质的化学式为_______;A原子距离B原子所在立方体侧面的最短距离为______pm(用x表示);该晶胞的密度为____g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、R是原子序数依次增大的短周期元素。a、b、c、d、e、f是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,f是由W、Z、R元素形成的化合物。m为元素Z形成的单质,W与X能形成化合物XW4。上述物质的转化关系如图所示,下列说法正确的是( )
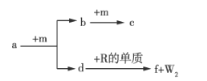
A.简单离子半径: R>Z
B.最高价氧化物对应水化物的酸性:X>Y
C.![]() 为离子化合物,含有离子键和共价键
为离子化合物,含有离子键和共价键
D.符合通式XnWn的化合物均能使溴的CCl4溶液因发生反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O+2H2O=4NaOH
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.NaOH溶液腐蚀玻璃瓶塞:SiO2 +2OH-=SiO32- + 2H2O
B.实验室制Cl2:MnO2+4HCl(浓) ![]() Mn2++2Cl-+2H2O+Cl2↑
Mn2++2Cl-+2H2O+Cl2↑
C.向Mg(OH) 2悬浊液中加入FeCl3溶液:2Fe3++3Mg(OH)2 ==2 Fe(OH)3+3Mg2+
D.向Ba(OH)2溶液中加入少量NaHSO3溶液: HSO3-+Ba2++OH-=BaSO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 都是非极性分子,
都是非极性分子,![]() 都是极性分子,由此推测ABn型分子是非极性分子的经验规律是( )
都是极性分子,由此推测ABn型分子是非极性分子的经验规律是( )
A.所有原子在同一平面上B.分子中每个键的键长应相等
C.A的相对原子质量小于BD.在ABn中A原子没有孤电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________。
(2)下列有关性质的比较,能用元素周期律解释的是_________。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________。
(4)实验室用如下方法制备H2S并进行性质验证。
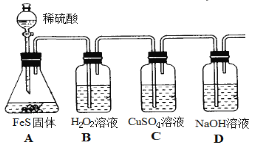
①设计B装置的目的是证明_________,B中实验现象为_______________。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;![]() 在同周期元素中原子半径最小。
在同周期元素中原子半径最小。
(1)B形成的双原子分子中,共价键的类型有__,化合物A2B中B原子采取__杂化。
(2)A2B和A2D的沸点较高者是__(填化学式),其原因是_。
(3)E原子的电子排布式为__。
(4)写出均由A、B、C、D四种元素组成的两物质的浓溶液发生反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于功能高分子材料的说法不正确的是( )
A.生物高分子材料、隐身材料、液晶高分子材料等属于功能高分子材料
B.高分子分离膜可用于海水淡化、分离工业废水、浓缩天然果汁等
C.用于制造![]() 芯片的良好半导体材料单晶硅属于功能高分子材料
芯片的良好半导体材料单晶硅属于功能高分子材料
D.在淀粉、纤维的高分子链上再接上含强亲水性原子团的支链,可提高它们的吸水能力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com