
 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
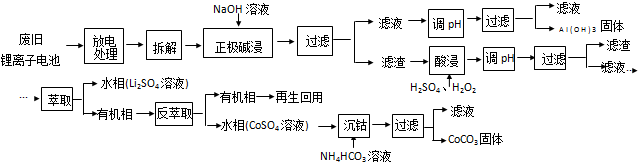
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Cl--2e-=Cl2↑ | B. | Cu2++2e-=Cu | ||
| C. | 4OH--4e-=2H2O+O2↑ | D. | 2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
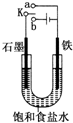 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D C A B | B. | A D C B | C. | B A D C | D. | A D B C |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com