
【题目】氯化亚铜(CuC1)在化工、印染、电镀等行业应用广泛。CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuC1的工艺过程如图所示:

回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式___________。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________,滤液中可循环利用的物质是___________。
(3)步骤⑤中,醇洗的目的是______________________。
(4)常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+,相关数据记录如下表所示:
实验编号 | 1 | 2 | 3 |
消耗K2Cr2O7溶液的体积/mL | 14.98 | 16.03 | 15.02 |
该样品中CuCl的质量分数___________。(保留4位有效数字)
(5)制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为___________,生成CuCl的离子方程式为______________________。

【答案】4Cu+NO3-+10H+=4Cu2++NH4++3H2O 使Cu2+反应完全,阻止生成的CuCl被氧气氧化 硫酸 有利于除去CuCl表面的水分,防止CuCl表面被氧化 89.55% [Cu(NH3)4]2++e-+2H2O=[Cu(NH3)2]++2NH3·H2O [Cu(NH3)2]++2H++Cl-=CuCl↓+2NH4+
【解析】
酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,烘干得到CuCl,以此来解答该题。
(1)步骤①中N元素被还原为最低价,应生成铵根离子,离子反应为4Cu+NO3-+10H+=4Cu2++NH4++3H2O;
(2)步骤②中,亚硫酸铵要略保持过量,可使Cu2+完全反应,阻止生成的CuCl被氧化,滤液中可循环利用的物质是硫酸;
(3)步骤⑤为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去CuCl固体表面的水分,防止水解、氧化;
(4)氯化亚铜与氯化铁发生Fe3++CuCl=Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,反应的关系式为6CuCl~6Fe2+~Cr2O72-,第二次实验误差较大,可舍去,K2Cr2O7溶液的体积为15mL,则n(K2Cr2O7)=0.1000mol/L×0.015L=1.5×10-3mol,由关系式可知10mL样品中n(CuCl)=9×10-3mol,则10.00g样品中m(CuCl)=9×10-3mol×![]() ×99.5g/mol=8.955g,则含量为
×99.5g/mol=8.955g,则含量为![]() ×100%=89.55%;
×100%=89.55%;
(5)阴极发生还原反应,[Cu(NH3)4]2+得电子生成[Cu(NH3)2]+,反应的电极反应式为[Cu(NH3)4]2++e-+2H2O=[Cu(NH3)2]++2NH3H2O,生成CuCl的离子方程式为[Cu(NH3)2]++2H++Cl-=CuCl+2NH4+。


科目:高中化学 来源: 题型:
【题目】钾的化合物广泛存在于自然界中。回答下列问题:
(l)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(2)钾的焰色反应为_____色,发生焰色反应的原因是__________________________________。
(3)叠氮化钾(KN3)晶体中,含有的共价键类型有_____________,N3-的空间构型为__________。
(4)CO能与金属K和Mn形成配合物K[Mn(CO)5],Mn元素基态原子的价电子排布式为______________。
(5)原子坐标参数可表示晶饱内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(l,0,0),则C原子的坐标参数为_____________。

(6)钾晶体的晶胞参数为a pm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为____________pm,晶体钾的密度计算式是_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1Na2SO3溶液的pH约为10;0.1mol·L–1NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的电极反应式
①Zn+H2SO4=ZnSO4+H2↑
正极_____________________,负极____________________;
②惰性电极电解硫酸铜溶液
阳极_____________________,阴极____________________;
总电解方程式________________________,总电解离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲和乙通过化合反应制备丙,如图是三种分子的模型图,根据微观示意图得出的结论错误的是
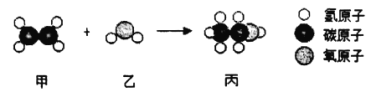
A. 甲的化学式为C2H4
B. 乙和丙都属于氧化物
C. 化学反应前后分子的种类都发生了改变
D. 保持乙化学性质的最小微粒是水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极,②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
A. ①③②④B. ①③④②C. ③④②①D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”,设制一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是_______,电解质溶液是_____________;
②正极的反应式为_____________________.
③若导线上转移电子1mol,则生成银___________克.
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
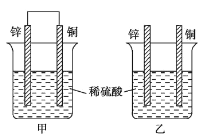
①在相同时间内,两烧杯中产生气泡的速度:甲____________乙(填“>”、“<“或“=” ).
②请写出图中构成原电池的负极电极反应式_______________. 电池工作时,溶液中SO42-向______极(填正、负)移动,电池工作完成后,溶液中SO42-浓度_________(填增大或减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
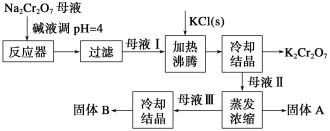

(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com