
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。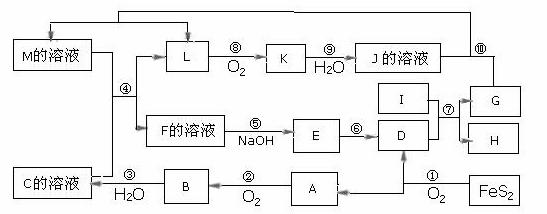
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________
(填写序号)。
(4)反应④ 的离子方程式是:_______________________________________
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
_____________________________________________________________________。
【答案】
(1)四(或4) VIII (2)1 :2 (3)③
(4)3Fe2+ + 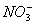 + 4H+=3Fe3+ + NO↑+2H2O
+ 4H+=3Fe3+ + NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH 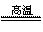 2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
【解析】本题涉及铁及其化合物,Al、HNO3、H2SO4、NOx等内容,综合考查考生熟练运用元素化合物知识解决问题的能力。由反应4FeS2+11O2  2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;由I为第三周期中熔点最高的金属知I为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体知K为NO2,J为HNO3,L为NO;又由G+HNO3
B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;由I为第三周期中熔点最高的金属知I为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体知K为NO2,J为HNO3,L为NO;又由G+HNO3 M+NO↑分析知G为Fe,H为Al2O3,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4
M+NO↑分析知G为Fe,H为Al2O3,M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 F+NO↑知,M为Fe(NO3)2,F为Fe(NO3)3或Fe2(SO4)3,至此全部物质已确定,题目所涉及的问题可顺利解决。
F+NO↑知,M为Fe(NO3)2,F为Fe(NO3)3或Fe2(SO4)3,至此全部物质已确定,题目所涉及的问题可顺利解决。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
1)有下列几种物质
A.金刚石和石墨 B.C2H6和C5H12 C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是 ;属于同素异形体的是 ;属于同系物的是 ;属于同位素的是 .
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是
A.两种不同元素的原子
B.一定是两种不同的离子
C.同一元素的原子和离子
D.两种不同元素的原子和离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
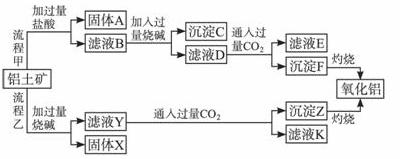
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成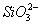 的离子方程式为_____________________________。
的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_______________(填化学式),写出该溶质的一种用途_______________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2: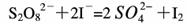
通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。________、___________(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
为了避免青铜器生成铜绿,以下方法正确的是
A 将青铜器放在银质托盘上
B 将青铜器保存在干燥的环境中
C 将青铜器保存在潮湿的空气中
D 在青铜器的表面覆盖一层防渗的高分子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: B : C: D :
(2)写出A、B、E三种微粒反应的离子方程式:
、
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:________________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①H2O2分子的电子式:________________。
②写出C的酸性溶液与双氧水反应的离子方程式:
_____________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:__________________________________________
_____________________________________________________________________。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在氧化还原化学反应中(2CuO+C 2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
2Cu+CO2),物质所含元素化合价升高,这种物质是 剂,在反应中 (“得”或“失”)电子;元素化合价降低,表明该元素的原子在反应中 (“得”或“失”)电子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com