
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32―)+c(HSO3-)+c(H2SO3) |
| C.c(Na+)+c(H+)=2c(SO32―)+2c(HSO3-)+c(OH―) |
| D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC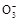 )+c(H+)>c(C )+c(H+)>c(C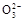 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S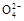 )>c(N )>c(N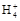 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC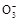 )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
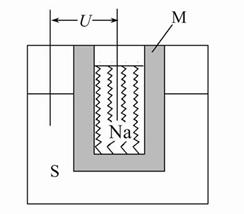
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

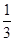 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Cu2+ | 5. 2 | 6. 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用惰性电极电解饱和食盐水:2Cl-+ 2H+=H2↑+ Cl2↑ |
| B.碱性氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH- |
| C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+ |
| D.碳酸钠溶液呈碱性:CO32-+2H2O=H2CO3+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com