
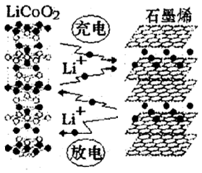
 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )| A. | 该电池若用隔膜可选用质子交换膜 | |
| B. | 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 石墨烯电池的优点是提高电池的储铿容量进而提高能量密度 | |
| D. | 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收 |
分析 根据电池反应式知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,根据二次电池的工作原理结合原电池和电解池的工作原理来解答.
解答 解:A、由电池反应,则需要锂离子由负极移向正极,所以该电池不可选用质子交换膜,故A错误;
B、放电时,LiCoO2极是正极,发生得电子的还原反应,电极反应式为:Li1-xCoO2+xLi++xe-=LiCoO2,故B错误;
C、石墨烯超强电池,该材料具有极佳的电化学储能特性,从而提高能量密度,故C正确;
D、根据电池反应式知,充电时锂离子加入石墨中,故D错误;
故选C.
点评 本题考查化学电源新型电池,侧重考查原电池和电解池原理,明确充放电各个电极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
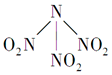 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 分子中N、O间形成的共价键是非极性键 | |
| B. | 分子中4个氮原子共平面 | |
| C. | 该分子中的中心氮原子还有一对孤电子对 | |
| D. | 15.2 g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作氧化剂 | |
| B. | CuH在氯气中燃烧的化学反应方程式为2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | |
| C. | CuH溶解在稀盐酸中生成的气体是氯气 | |
| D. | 如果选项C反应中生成了标准状况下22.4 L的气体,则转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 二氧化硅与强碱反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
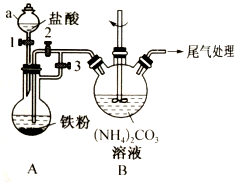 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 | |
| B. | 不同的气体,若体积相同,则它们所含的分子数必相同 | |
| C. | 气体的摩尔体积是指1mol任何气体所占的体积都是22.4L | |
| D. | 恒温恒压条件下,反应前后气体的体积之比等于气体的物质的量之比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com