
电解原理在化学工业中有广泛的应用。如图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。

请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ,在X极附近观察到的现象是 。电解液中向X极方向移动的离子是 。
②Y电极上的电极反应式为 ,
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②Y电极的电极反应式为 (说明:杂质发生的反应不必写出。)
③溶液中的c(Cu2+)与电解前相比 (填“变大”、“变小”或“不变”)。
(1)①2H2O + 2e- = H2 + 2OH- (2H++2e-=H2↑)有气泡产生,溶液变红 Na+ ,H+
②2Cl- - 2e-=Cl2
(2)①精铜 ②Cu-2e-=Cu2+ ③变小
【解析】
试题分析:(1)X电极和电源的负极相连,所以作阴极。溶液中的氢离子放电,电极反应式是2H++2e-=H2↑。氢离子放电,破坏了阴极周围水的电离平衡,导致阴极周围溶液显碱性,所以溶液显红色。电解液中向X极(阴极)方向移动的离子是阳离子:Na+ ,H+②Y电极和电源的正极相连,作阳极。溶液正的氯离子放电生成氯气,电极反应式是2Cl-—2e-=Cl2↑。
(2)粗铜精炼时,粗铜和电源的正极相连,作阳极。纯铜和电源的负极相连,作阴极,硫酸铜作电解质溶液,所以①X电极材料是纯铜,电极反应式是Cu2++2e-=Cu;②Y电极材料是粗铜,电极反应式是Cu-2e-=Cu2+。③阳极其他金属失电子的时候,溶液中的Cu2+ 得电子,所以精炼过程中,溶液中的c(Cu2+)变小。
考点:电解池的分析和粗铜电解精炼


科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(必修)(解析版) 题型:选择题
下列叙述不正确的是
A.14 C与12C、13C互为同位素 B.乙醇和甲醚是同分异构体
C.金刚石和石墨互为同素异形体 D.14C与12C的性质完全不同
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高二3月质检化学试卷(解析版) 题型:选择题
维生素C的结构简式为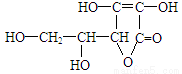 ,有关它的叙述错误的是 ( )
,有关它的叙述错误的是 ( )
A.是一个环状的酯类化合物 B.在碱性溶液中能稳定地存在
C.容易溶解于乙醇 D.易起氧化及加成反应
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)
B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生
C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.拆开物质中的化学键一定需要吸收能量
C.应用盖斯定律,无法计算某些难以直接测量的反应焓变
D.化学反应都伴随着能量变化和其他各种现象的出现
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2(s)+Pb(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(I),根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e-=PbSO4↓
C. PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
取100 mL 2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量的6mol/L的盐酸 B.用酒精灯适当加热
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
今有两种盐的稀溶液,分别是a mol NaX溶液和b mol
NaX溶液和b mol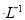 NaY溶液,下列说法不正确的是( )。
NaY溶液,下列说法不正确的是( )。
A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c (Y-)+c(HY) ;则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY
D.若两溶液等体积混合,测得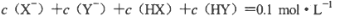
则可推出a+b=0.2 mol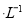
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:填空题
能源短缺是人类社会面临的重大问题,世界各国都在努力寻找新能源,探求绿色能源的开发。甲醇是一种可再生能源,是一种污染性较小,热值较大的能源,因而具有广泛的开发价值和良好的应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
反应Ⅱ:
①上述反应符合“原子经济”原则的是_________(填“I’’或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)

由表中数据判断△H1_________0(填“>”、“=”或“<”),说明生成物的总能量一定_______(填“>”、“=”或“<”)反应物的总能量。
③反应Ⅱ反应历程如下图,回答下列问题;在反应体系中加入催化剂,反应速率增大,E1、E2和△H2的变化是:E1_________、E2_________、△H2_________(填“增大”“减小”“不变”)。

(2)最新研制的一种新型甲醇电池示意图如图,电池的两极分别充人甲醇和氧气(池内为酸性介质)。则电池工作时____________(填a或b)为正极,a极的电极反应式为______________。
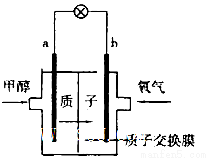
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com