
【题目】燃煤烟气中的![]() 可用连二亚硫酸根(
可用连二亚硫酸根(![]() )为媒介处理使其转化为
)为媒介处理使其转化为![]() ,其原理如图所示。下列说法正确的是( )
,其原理如图所示。下列说法正确的是( )

A.燃煤烟气中![]() 的处理仅利用的是电解原理
的处理仅利用的是电解原理
B.阴极区的电极反应式为![]()
C.若通电过程中吸收![]() (标准状况下),则阳极可以产生
(标准状况下),则阳极可以产生![]() 气体
气体
D.反应一段时间后,![]()
【答案】C
【解析】
![]() 与连二亚硫酸根(
与连二亚硫酸根(![]() )发生氧化还原反应,生成
)发生氧化还原反应,生成![]() 和亚硫酸根,亚硫酸根进入阴极区发生还原反应,生成
和亚硫酸根,亚硫酸根进入阴极区发生还原反应,生成![]() ,阳极区水电离的氢氧根离子放电,发生氧化反应,生成氧气和氢离子,硫酸浓度增大,据此回答问题。
,阳极区水电离的氢氧根离子放电,发生氧化反应,生成氧气和氢离子,硫酸浓度增大,据此回答问题。
A.燃煤烟气中的![]() 进入吸收柱,被从电解池中生成的S2O42-转化为NH4+,所以NO的处理不仅仅是电解原理,还有在吸收柱中的氧化还原反应,A错误;
进入吸收柱,被从电解池中生成的S2O42-转化为NH4+,所以NO的处理不仅仅是电解原理,还有在吸收柱中的氧化还原反应,A错误;
B.根据图示,阳极生成的氢离子通过质子交换膜进入阴极,所以阴极区的电极反应式为![]() ,B错误;
,B错误;
C.若通电过程中吸收![]() (标准状况下),即吸收了0.2molNO,根据电子转移守恒可知,NO~NH4+转移5个电子,2OH-~O2转移了4个电子,则4NO~5O2,阳极可以产生
(标准状况下),即吸收了0.2molNO,根据电子转移守恒可知,NO~NH4+转移5个电子,2OH-~O2转移了4个电子,则4NO~5O2,阳极可以产生![]() 气体,C正确;
气体,C正确;
D.阳极区实质是水电离产生的氢氧根离子发生氧化反应,生成氧气和氢离子,反应一段时间后,c1<c2,D错误。
答案为C。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
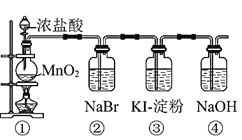
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
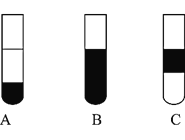
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:________________
(2)五种元素原子半径由大到小的顺序是(写元素符号) .
(3)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,X和Z组成的化合物的化学式为___________________
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为_________
B离子反应方程式为_________
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
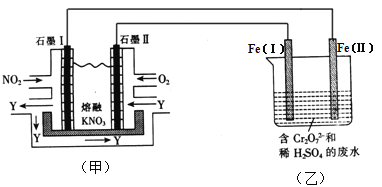
(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅱ是电池的 极;石墨Ⅰ附近发生的电极反应式为 。
(2)工作时,甲池内的NO3-离子向 极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为 。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为 。
(4)若溶液中减少了0.01 mol Cr2O72-,则电路中至少转移了 mol电子。
(5)向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至 。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
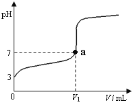
A. 上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B. 图中V1 <20 mL
C. a点对应的溶液中:c (CH3COO-)=c (Na+)
D. 当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇耐高温、易存储热值高、节能环保,可做燃料,又是重要的化工原料。科学家用太阳能分解水生成的氢气在催化剂作用下与![]() 反应生成甲醇。已知:
反应生成甲醇。已知:![]() 、
、![]() 和
和![]() 的燃烧热H分别为
的燃烧热H分别为![]() 、
、![]() 和
和![]() 。请回答下列问题:
。请回答下列问题:
(1)用太阳能分解![]() 水消耗的能量是________
水消耗的能量是________![]() 。
。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________。
(3)![]() 催化加氢合成甲醇(反应Ⅱ)中伴随着反应Ⅰ的发生:
催化加氢合成甲醇(反应Ⅱ)中伴随着反应Ⅰ的发生:
反应Ⅰ:![]()
反应Ⅱ:![]()
在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
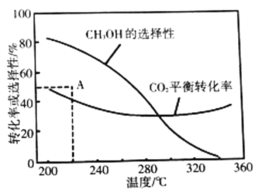
平衡转化率和平衡时![]() 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中:![]() 的选择性
的选择性![]()
①温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是_________。
平衡转化率随温度升高而上升的原因是_________。
②220℃时,在催化剂作用下![]() 与
与![]() 反应一段时间后,测得
反应一段时间后,测得![]() 的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高
的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高![]() 选择性的措施有_________________(写出两点)。
选择性的措施有_________________(写出两点)。
(4)在体积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() 发生反应Ⅱ,到平衡时氢气的转化率为25%,求该反应的平衡常数K=________。(结果保留二位有效数字)
发生反应Ⅱ,到平衡时氢气的转化率为25%,求该反应的平衡常数K=________。(结果保留二位有效数字)
(5)研究证实,![]() 也可在硫酸溶液中用惰性电极电解生成甲醇,生成甲醇的电极反应式为__________,另一极电解产物是________________。
也可在硫酸溶液中用惰性电极电解生成甲醇,生成甲醇的电极反应式为__________,另一极电解产物是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿(主要成分是Fe(CrO2)2,Cr元素为+3价。含少量MgCO3、Al2O3、SiO2等杂质)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
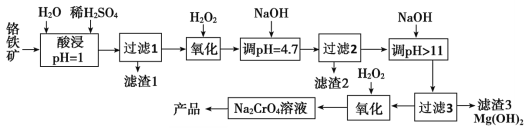
已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__。
(2)若省略“过滤2”步骤,产品中可能混有__(写化学式)。
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为__。
(4)制取铬酸钠后的酸性废水中含有Cr2O![]() ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O![]() 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O![]() 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
(5)产品铬酸钠可用如图所示方法冶炼铬。
![]()
②的化学方程式为__,在实验室中引发该反应用到的两种药品是__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图(见下页):
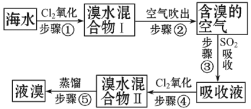
(1)步骤①反应的离子方程式是___。
(2)步骤③反应的化学方程式是___,从理论上考虑,下列也能吸收Br2的是___。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80℃~90℃。温度过高或过低都不利于生产,请解释原因:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com