
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
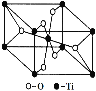
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。
【答案】3d24s2CN-(或NO+、C22-)CO2分子产生白色沉淀[Co (NH3)5SO4]Br6
【解析】
(1)根据构造原理,由原子序数即可写出基态原子的电子排布式,进而可写出价电子排布式;
(2)根据等电子体的概念写出符合题目要求的等电子体;
(3)可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
(4)根据题目中提供的物理性质来判断晶体类型;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,与BaCl2或AgNO3溶液反应的离子肯定为外界离子,由此可判断络合物的组成;
(6)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数。
(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,因此,本题正确答案是:3d24s2;
(2)CO为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+、C22-),因此,本题正确答案是:CN-(或NO+、C22-);
(3)在CH2Cl2、C6H6、CO2、C2H4中,分子构型分别为四面体形、平面三角形、直线形、平面形,所以碳原子的杂化方式分别为sp3、sp2、sp、sp2杂化,采取sp2杂化的分子有C6H6、C2H4,所以sp杂化的是CO2,因此,本题正确答案是:CO2;
(4)因TiCl4在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断TiCl4是由共价键结合的分子,晶体类型属于分子晶体,
因此,本题正确答案是:分子;
(5)由[Co(NH3)5Br]SO4可以知道,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀。加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为[Co (NH3)5SO4]Br,
因此,本题正确答案是:产生白色沉淀;[Co (NH3)5SO4]Br;
(6)观察晶胞结构,可以知道每个钛周围距离最近的氧原子有6个,即钛的配位数为6,
因此,本题正确答案是:6。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是_________(至少答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH2,总反应为:xNi(OH)2+M![]() xNiOOH+MHx,试写出放电过程中负极
xNiOOH+MHx,试写出放电过程中负极
反应式____________。
(3)施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,已知NaBH4与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为__________,用离子方程式表示出溶液显碱性的原因_______________。
(4)在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入ag的储氢合金(M)和bmol氢气发生如下反应:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。
2MHx(s) ΔH<0,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如图1所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是______。

(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢;

①在恒容密闭容器中,控制不同温度进行乙苯的脱氢实验。以乙苯起始浓度均为c mol/L测定乙苯的转化率,结果如图2所示。图中A为乙苯的平衡转化率与温度关系曲线,B曲线表示不同温度下反应经过相同时间且为达到化学平衡时乙苯的转化率。试说明随温度的升高,曲线B向曲线A逼近的原因__________。
②维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转换率为a,则在该温度下反应的平衡常数K=__________(用a等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加B.氧化剂本身发生氧化反应
C.一定有电子转移(得失或偏移)D.氧化反应一定先于还原反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是

A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲可以判断出反应A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 图乙表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C. 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D. 图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。

下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱核磁共振、X射线行射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构、配合物结构研究等。
(1)过渡元素Cr原子的基态电子排布式为______,Cr的核外电子由激发态跃迁至基态时产生的光谱是______ (填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。

①组成该晶体的元素中电负性最大的是______,其中S的杂化类型有_______。
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为______,原因是______。
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有_________。
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_____(用离子方程式表示)。
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线行射分析其晶胞结构如图所示。

①晶胞中Na堆积形成___________(填形状)空间结构,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是__________。
②已知晶胞边长为anm,晶胞中Na的半径为bnm,则He的半径为_____nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4===ZnSO4+H2↑,下列叙述不正确的是

A. 反应过程中能量关系可用上图表示
B. 若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质
C. 若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下)
D. 若设计为原电池,负极有电流流入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)写出⑦元素名称_________,表中能形成两性氢氧化物的元素是__________(填元素符号)。
(2)画出⑥的离子结构示意图___________,写出②含有10个中子的核素的化学符号_________。
(3)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应_________________________________。
(4)①②⑥⑧四种元素能组成多种盐(每种盐中都只含有这四种元素),写出其中两种盐溶液能发生反应的离子方程式_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com