
| 消耗量 |
| 起始量 |
| ||
| △ |
| ||
| △ |
| 2m |
| 5x-2m |
| 3m |
| 3x |
| 15 |
| 46 |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | H2C2O4溶液 | KMnO4溶液 | 硫酸溶液 | 温度/℃ | ||
| 浓度 (mol/L) | 体积 (mL) | 浓度 (mol/L) | 体积 (mL) | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 4mL 4mol/L | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、6 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z | W |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 | 0 |
| 平衡浓度/mol?L-1 | 0..4 | 0.2 | 1.2 | 0.6 |
| A、反应达到平衡时,Y的转化率为90% |
| B、反应可表示为X(g)+3Y(g)═2Z(g)+W(g),其平衡常数为270 L?mol-1 |
| C、增大压强平衡向正反应方向移动,平衡常数不变 |
| D、改变温度或向平衡体系中加入X都会使平衡移动,平衡常数也会随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
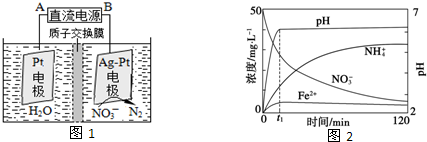
查看答案和解析>>
科目:高中化学 来源: 题型:
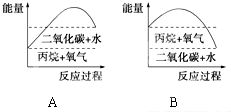 北京奥运会火炬使用的燃料为丙烷(C3H8),它是一种价格低廉的常用燃料,丙烷是由碳和氢两种元素组成,燃烧后只有二氧化碳和水,不会对环境造成污染.已知1g丙烷完全燃烧放出50.452kJ热量.试回答下列问题:
北京奥运会火炬使用的燃料为丙烷(C3H8),它是一种价格低廉的常用燃料,丙烷是由碳和氢两种元素组成,燃烧后只有二氧化碳和水,不会对环境造成污染.已知1g丙烷完全燃烧放出50.452kJ热量.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com