
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g).已知常温常压下反应的能量变化如图1所示: 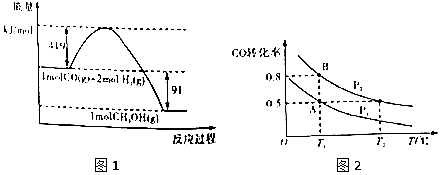 ②
②
化学键 | H﹣H | H﹣O | O=O |
键能kj/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280kJ/mol
O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ ![]() O2(g)=H2O(I)△H=﹣284kJ/mol
O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式;
(3)H﹣O的键能x值为;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL﹣1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL﹣1min﹣1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是 .
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
【答案】
(1)510
(2)CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJ?mol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJ?mol﹣1
(3)462
(4)7
(5)BC
【解析】解:(1)由图形可知甲醇的活化能为(419+91)kJ/mol=510kJ/mol,所以答案是:510;(2)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物. 由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=﹣91kJ/mol,
又已知:②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣280kJ/mol③H2(g)+
O2(g)═CO2(g)△H=﹣280kJ/mol③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣284 kJ/mol
O2(g)═H2O(l)△H=﹣284 kJ/mol
根据盖斯定律,③×2+②﹣①可得:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1 ,
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1 ,
所以答案是:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1;(3)已知:H2(g)+
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1;(3)已知:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣284 kJ/mol,
O2(g)═H2O(l)△H=﹣284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol
二者相加可得:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣240 kJ/mol,
O2(g)═H2O(g)△H=﹣240 kJ/mol,
反应热=反应物总键能﹣生成物总键能,则436kJ/mol+ ![]() ×496kJ/mol﹣2×x kJ/mol=﹣240kJ/mol,解得x=462,
×496kJ/mol﹣2×x kJ/mol=﹣240kJ/mol,解得x=462,
所以答案是:462;(4)A、B两容器温度相同,即化学平衡常数相等,A点时转化率为50%,则K= ![]() =1,且B点时CO的转化率为0.8,则
=1,且B点时CO的转化率为0.8,则
CO(g)+ | 2H2(g) | CH3OH(g) | |
起始(mol) | 10 | 30 | 0 |
转化(mol) | 8 | 16 | 8 |
平衡(mol) | 2 | 14 | 8 |
设体积为VL,则有K= 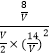 =1,V=7L,
=1,V=7L,
所以答案是:7;(5)A.丙为甲醇的分解是气体体积增大的反应,所以丙恒温恒压,体积变大,甲恒温恒容,体积不变,所以,V甲<V丙 , 故A错误;
B.合成甲醇是放热反应,其逆反应甲醇分解就是吸热的,乙绝热容器,丙恒温,所以乙反应后比丙温度低,向吸热方向进行的程度小,平衡时乙中甲醇浓度比丙高,CO和氢气浓度比丙低,K乙>K丙 , 故B正确;
C.条件相同时,甲与乙是等效平衡.甲与乙容器体积相同,乙分解甲醇吸热导致乙比甲温度低,平衡向合成甲醇方向移动,平衡时甲醇浓度乙大于甲,即c乙>c甲 , 故C正确;
D.甲与丙起始温度和起始体积相同,恒温条件下反应,丙在恒压条件下分解甲醇生成氢气和CO,平衡时体积比反应前大,即平衡时丙体积大于甲,则压强甲大于丙,所以υ甲>υ丙 , 故D错误.
所以答案是:BC.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1molL﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示. 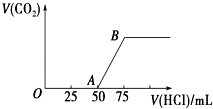
(1)写出OA段所发生反应的离子方程式: .
(2)NaOH在吸收CO2后,所得溶液的溶质为 , 其物质的量浓度之比为 .
(3)产生的CO2体积(标准状况下)为 .
(4)原NaOH溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知相同条件下,下列反应的焓变和乎衡常数分别表示为: ①2H2O(g)=O2(g)+2H2(g)△H1 K1=x
②Cl2(g)+H2(g)=2HCl(g)△H2 K2=y
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3 K3=x
则下列关系正确的是( )
A.△H3=△H1+2△H2 x=xy2
B.H3=△H1+△H2 z=x+y
C.H3=△H1+2△H2 x=x﹣y2
D.H3=△H1+△H2 z= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请预测有机物丙烯酸(CH2=CH-COOH)的发生的反应类型可能有( )
①加成反应②水解反应③酯化反应④中和反应⑤氧化反应.
A. 只有①③B. 只有①③④C. ①②③④⑤D. 只有①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____.
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B______;C________;沉淀D_____;溶液E________.
(3)写出①、②、③、④四个反应方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需1 mol·L-1的CuSO4溶液750 mL,配制时应选用的容量瓶的规格和称取CuSO4固体的质量分别为
A. 容量瓶:500 mL、250 mL各一个; CuSO4:共120.0 g
B. 容量瓶:750 mL、 CuSO4:120.0 g
C. 容量瓶:1 000 mL、CuSO4晶体:250.0 g
D. 容量瓶:1 000 mL、 CuSO4:160.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol, 2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol,
C(s)+0.5O2(g)=CO(g)△H3=akJ/mol,则a= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com