
| A. | 1 L 0.1 mol/L Na2CO3溶液中,阴离子总数大于0.1 NA | |
| B. | 常温常压下,1 mol甘氨酸中含C-H键数目为3 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA | |
| D. | 50℃时,10 L pH=13的NaOH溶液中含有的OH-数目为NA |
分析 A、碳酸根离子水解生成氢氧根离子和碳酸氢根离子;
B、根据甘氨酸的结构简式为:NH2-CH2-COOH来分析;
C、NO2与水的反应中,3molNO2转移2mol电子;
D、在50℃时,水的离子积Kw大于10-14.
解答 解:A、常温下,100mL 1mol•L-1 Na2CO3溶液中,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,阴离子总数大于0.1NA,故A正确;
B、根据甘氨酸的结构简式为:NH2-CH2-COOH可知,1mol甘氨酸含2molC-H键,故B错误;
C、标准状况下,6.72 L NO2的物质的量n=$\frac{6.72L}{22.4L/mol}$=0.3mol,而NO2与水的反应中,3molNO2转移2mol电子,故0.3mol二氧化氮转移0.2mol电子,故C错误;
D、在50℃时,水的离子积Kw大于10-14,10 L pH=13的NaOH溶液中OH-的物质的量浓度不是0.1mol/L,故OH-数目不为NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 溶液 | X | Y | Z | W |
| pH | 12 | 2 | 7.7 | 5.6 |
| A. | 将Z溶液加水稀释至浓度为0.001mol/L,所得溶液pH=6.7 | |
| B. | 四种溶液中,水的电离程度最大的是W溶液 | |
| C. | 将X、W溶液按1:2的体积比混合,所得溶液中:c(H+)>c(OH-) | |
| D. | 将11mLX溶液与9mLY溶液混合(忽略混合时体积的变化),所得溶液pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
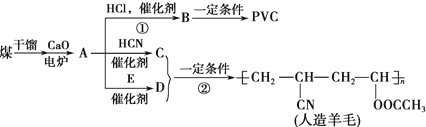
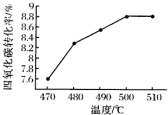
 ,CH2C=HC-CN.
,CH2C=HC-CN.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
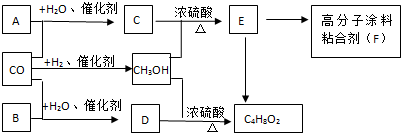
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com