
肼(N2H4)﹣空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%﹣30%的KOH溶液.电池总反应为:N2H4+O2=N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是()
A. 电池工作时,负极附近溶液的碱性增强
B. 正极的电极反应式是:O2+4H++4e﹣=2H2O
C. 负极的电极反应式是:N2H4+4OH﹣﹣4e﹣=4H2O+N2↑
D. 溶液中阴离子向正极移动
考点: 原电池和电解池的工作原理.
分析: 该燃料电池为碱性电池,负极上充入燃料肼,电极反应式为N2H4+4OH﹣﹣4e﹣═4H2O+N2↑,正极上充入空气,得电子发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,电解质溶液中阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答: 解:A.电池工作时,负极电极反应式为N2H4+4OH﹣﹣4e﹣═4H2O+N2↑,溶液中负极附近溶液中氢氧根离子参加反应,碱性减弱,导致电解质溶液pH减小,故A错误;
B.正极上充入空气,得电子发生还原反应,电极反应式为O2+2H2O+4e﹣=4OH﹣,故B错误;
C.负极电极反应式为N2H4+4OH﹣﹣4e﹣═4H2O+N2↑,故C正确;
D.电解质溶液中阴离子向负极移动,故D错误;
故选C.
点评: 本题考查化学电源新型电池,燃料电池中负极上通入燃料、正极上通入氧化剂,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,注意酸性介质中不能生成氢氧根离子,为易错点.


科目:高中化学 来源: 题型:
一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓)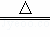 CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是()
CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是()
A. 溶液中c(Na+)=2c(SO42﹣)
B. 沉淀的物质的量等于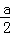 mol
mol
C. 标况下,生成SO2的体积<11.2aL
D. 原浓硫酸中H2SO4的物质的量>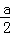 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的NaOH溶液时,可造成所配溶液浓度偏高的是()
A. 所用NaOH已吸潮
B. 向容量瓶滴加水时液面低于刻度线即摇匀
C. 有少量NaOH溶液残留在烧杯内
D. 向容量瓶加水时眼睛一直仰视液面
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若要配制100mL0.1mol•L﹣1Na2SO4溶液,需称量Na2SO4的质量为1.4g.
(2)将2240mL氨完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为1mol•L﹣1.(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨.若需要2240mL(标准状况)氨,求至少需要氯化铵的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是()
A. Y的阴离子Y﹣的还原性强于X的阴离子X﹣
B. X的氢化物的水溶液的酸性比Y的氢化物的水溶液的酸性强
C. X的单质X2能将Y的阴离子Y﹣氧化成Y2
D. X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
反应H2(g)+I2(g)⇌2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是()
①单位时间内断裂n mol H﹣H键的同时形成2n mol H﹣I键
②单位时间内生成n molI2的同时生成2n molHI
③2v正(H2)=v逆(HI)
④HI分子数不再改变
⑤混合气体颜色不再改变
⑥混合气体压强不再改变.
A. ②④⑤⑥ B. ②③④⑤ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中数据合理的是()
A. 用10 mL 量筒量取5.2 mL盐酸
B. 用广泛pH试纸测得某溶液的pH值为12.5
C. 用托盘天平称取25.12gNaCl固体
D. 用100 mL容量瓶配制50mL0.1 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4.一般而言,该式中m 大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
|
| A. | HClO3 | B. | H2SeO3 | C. | H2BO2 | D. | HMnO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com