
 CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1 CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
 CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________ CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1 (2)①小于 ②增大 不变 (3)没有 此时
CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1 (2)①小于 ②增大 不变 (3)没有 此时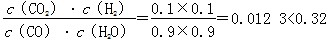 >
> CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 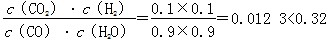 ,故反应未达到平衡。此时反应向正反应方向进行,故v正>v逆。
,故反应未达到平衡。此时反应向正反应方向进行,故v正>v逆。

科目:高中化学 来源:不详 题型:单选题
|
已知:① Cu(s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+2H2O(l) △H 1 ②2H2O(l)=2H2(g)+O2(g) △H 2 ③2H2O2(l)=2H2O(l)+O2 (g) △H 3 ④Cu(s)+2H+ (aq)=Cu2+(aq)+H2 (g) △H4 则ΔH4的正确表达式为( )
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+ H2(g);
CO(g)+ H2(g); CO (g)+ 3H2(g)
CO (g)+ 3H2(g)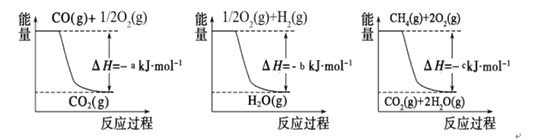
 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol·L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g·L-1) | ρ1 | ρ2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+45.2 kJ·mol-1 | D.+69.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+ N2(g) △H<0,
2CO2(g)+ N2(g) △H<0,
 N2O4(g) ΔH=-56.9 kJ/mol ②
N2O4(g) ΔH=-56.9 kJ/mol ② 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。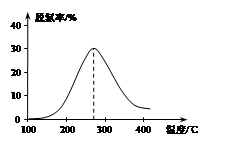

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-252.9 kJ·mol-1 | B.+252.9 kJ·mol-1 |
| C.-604.5 kJ·mol-1 | D.+604.5 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com