
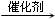
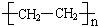 .
.分析 (1)苯和液溴在铁的催化作用下生成溴苯和溴化氢;
(2)苯与浓硝酸在浓硫酸催化下,加热生成硝基苯;
(3)乙烯和氯化氢可以发生加成反应生成氯乙烷;
(4)乙烯含有碳碳双键,可发生加聚反应生成聚乙烯;
(5)苯酚与氢氧化钠反应,反应生成苯酚钠和水.
解答 (1)在催化剂的作用下,苯环上的氢原子溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr,
故答案为:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(2)苯与浓硝酸在浓硫酸催化下,60℃时的取代方程式是;C6H6+HNO3 $→_{50℃-60℃}^{浓硫酸}$C6H5-NO2+H20;
故答案为:C6H6+HNO3 $→_{50℃-60℃}^{浓硫酸}$C6H5-NO2+H20;
(3)乙烯和氯化氢可以发生加成反应,即:CH2=CH2+HCl$\stackrel{一定条件下}{→}$CH3CH2Cl,
故答案为:CH2=CH2+HCl$\stackrel{一定条件下}{→}$CH3CH2Cl;
(4)乙烯含有碳碳双键,可发生加聚反应生成聚乙烯,方程式为n H2C=CH2 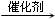
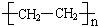 ,
,
故答案为:n H2C=CH2 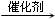
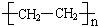 ;
;
(5)苯酚与氢氧化钠反应,反应生成苯酚钠和水,反应为C6H5OH+NaOH→C6H5ONa+H2O,
故答案为:C6H5OH+NaOH→C6H5ONa+H2O.
点评 本题考查有机物的机构和性质,为高考常见题型,注意把握有机物的官能团的性质以及相关方程式的书写,为解答该题的关键.


科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池负极发生的电极反应是还原反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池在工作时其正极不断产生电子经外电路流向负极 | |
| D. | 原电池的电极只能由两种不同的金属构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,H2SO4浓度增加 | |
| B. | 放电时,负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸 | |
| D. | 在充电时,阴极发生的反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-═Fe2S3 | |
| C. | 过量的铁与稀硝酸溶液:3Fe+8H++2NO3-═3Fe2++4H2O+2NO? | |
| D. | 铁粉放入氯化铁溶液:Fe+Fe3+═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧氧化法可以对有机物进行定性与定量的元素分析 | |
| B. | 提纯液体混合物常用重结晶法 | |
| C. | 红外光谱与核磁共振氢谱可以用于确定有机物的官能团和结构式 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com