
| A、氢氧化镁和稀盐酸反应 |
| B、Ba(OH)2溶液滴入稀硫酸中 |
| C、澄清石灰水和稀硝酸反应 |
| D、醋酸溶液与氢氧化钠溶液反应 |


科目:高中化学 来源: 题型:
| A、2NaOH+H2SO4═Na2SO4+2H2O |
| B、Fe+H2SO4═FeSO4+H2↑ |
| C、BaCl2+H2SO4═BaSO4↓+2HCl |
| D、H2+CuO═Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医用酒精 | B、HCl(气态) |
| C、水煤气 | D、豆浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Cl-、NO3-、K+ |
| B、Fe2+、H+、NO3-、SO42- |
| C、Al3+、Mg2+、NO3-、OH- |
| D、Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、稀硫酸和氨水反应:H++NH3?H2O═NH4++H2O |
| C、氢氧化钠和硫酸反应:2OH-+H2SO4═SO42-+2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:

 )是一种重要的工程塑料.
)是一种重要的工程塑料.

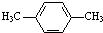 为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH
为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH| 浓H2SO4 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
 合成PBT的反应流程图为:
合成PBT的反应流程图为:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用
(1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 说明产品中含有NaHCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠原子有强还原性,钠离子有弱氧化性 |
| B、若电解熔融的氯化钠,则钠离子被氧化成钠原子 |
| C、钠很活泼,在一定条件下可以置换出金属活动性顺序表钠后面的金属 |
| D、钠是电和热的良导体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com