
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾(FeSO4·7H2O)的流程如下:
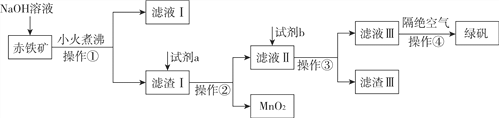
(1)滤液Ⅰ中所含的阴离子有________。
(2)试剂a为________,试剂b投入到滤液Ⅱ发生的所有反应的化学方程式为________。
(3)实验室中操作①所需的玻璃仪器有________。
(4)操作④的名称为________。
【答案】OH-、AlO2-、SiO32-硫酸Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+FeSO4、
Fe+H2SO4=H2↑+FeSO4玻璃棒、漏斗、烧杯蒸发浓缩、冷却结晶、过滤(洗涤、干燥)
【解析】(1)由上述分析可知,滤液Ⅰ中所含的阴离子有OH-、AlO2-、SiO32-;
(2)试剂a为硫酸,试剂b投入到滤液Ⅱ发生的所有反应的方程式为Fe+Fe2(SO4)3=3FeSO4、Fe+CuSO4=Cu+FeSO4、Fe+H2SO4=H2↑+FeSO4;
(3)实验室中操作①为过滤,所需的玻璃仪器有玻璃棒、漏斗、烧杯;
(4)操作④的名称为蒸发浓缩、冷却结晶、过滤(洗涤、干燥),可得到绿矾晶体。


科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g) △H<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
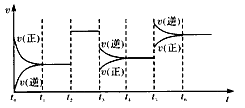
A.t2时加入了催化剂 B.T3时平衡的移动可使化学平衡常数减小
C.t5时增大了压强 D.T6时达到平衡后反应物的转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应 A2(g)+3B2(g)![]() 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )
2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )
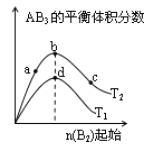
A.加入催化剂可以使状态 d 变为状态 b
B.若 T1>T2,则逆反应一定是放热反应
C.达到平衡时 A2 的转化率大小为: b>a>c
D.在T2 和n(A2)不变时达到平衡,AB3 的物质的量大小为: c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同
B. 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色
C. 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大
D. 乙酸乙酯在碱性条件下的水解反应称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH4+ 、Al3+、K+ |
可能大量含有的阴离子 | Cl﹣、Br﹣、I﹣、ClO﹣、AlO2﹣ |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
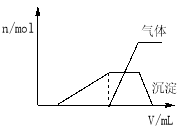
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有 ;
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
n(Cl﹣) | 1.25mol | 1.5mol | 2mol |
n(Br﹣) | 1.5mol | 1.4mol | 0.9mol |
n(I﹣) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
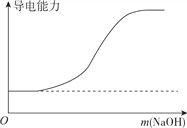
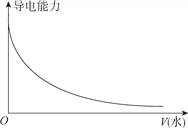
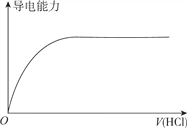
【题目】下列图象不正确的是
A. 向100ml0.1mol·L-1H2SO3溶液中滴加0.1mol·L-1Ba(OH)2溶液至过量
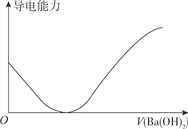
B. 向100ml0.1mol·L-1H2SO4溶液中加入NaOH固体
C. 向一定浓度的氯化钠溶液中加水
D. 向蒸馏水中通入HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列家庭小实验中不涉及化学变化的是( )
A.用熟苹果催熟青香蕉 B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒酿 D.用木炭除去冰箱中的异味
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com