
【题目】下列说法不正确的是
A.已知草酸氢钾溶液呈酸性,则在0.1mol·L-1KHC2O4溶液中c(C2O42-)>c(K+)>c(H2C2O4)
B.常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7
C.常温下,在0.10mol·L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大
D.pH=3的0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
【答案】A
【解析】
A.KHC2O4在溶液中发生电离:KHC2O4=K++ HC2O4-,草酸是二元弱酸,HC2O4-在溶液中存在电离平衡和水解平衡,所以c(K+)>c(C2O42-);由于草酸氢钾溶液呈酸性,说明c(C2O42-)> c(H2C2O4),所以则在0.1mol·L-1KHC2O4溶液中微粒浓度关系:c(K+)>c(C2O42-)>c(H2C2O4),A错误;
B.常温下向氯化铵溶液中加入少量氨水,在该溶液中存在电荷守恒,则c(NH4+)+c(H+)=c(OH-)+c(Cl-),由于溶液中c(NH4+)=c(Cl-),所以c(H+)=c(OH-),则混合液的pH=7,B正确;
C.CH3COOH在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,若在常温下,在0.10mol·L-1CH3COOH溶液中加入少量CH3COONa晶体,CH3COONa电离产生CH3COO-,使溶液中c(CH3COO-)增大,电离平衡逆向移动,能使CH3COOH的电离度降低,溶液中的c(H+)降低,所以pH增大,C正确;
CH3COO-+H+,若在常温下,在0.10mol·L-1CH3COOH溶液中加入少量CH3COONa晶体,CH3COONa电离产生CH3COO-,使溶液中c(CH3COO-)增大,电离平衡逆向移动,能使CH3COOH的电离度降低,溶液中的c(H+)降低,所以pH增大,C正确;
D.根据溶液显电中性,可知溶液中(Na+)+c(H+)=c(OH-)+c(A-),根据物料守恒可得2(Na+)=c(HA)+c(A-),第一个式子扩大2倍减去第二个式子,整理可得:2c(H+)+c(HA)=c(A-)+2c(OH-),D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
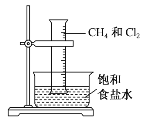
A.该反应的生成物只有四种
B.该反应的条件是光照
C.该反应属于取代反应
D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
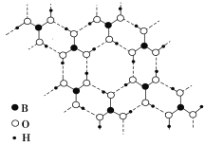
A. 正硼酸晶体属于原子晶体
B. H3BO3分子的稳定性与氢键有关
C. 分子中硼原子最外层为8电子稳定结构
D. 含1 mol H3BO3的晶体中有3 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1。反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1。反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 平衡后若升高温度,H2S浓度增加,表明该反应是吸热反应
B. 当体系的压强保持不变时,表明该反应达到化学平衡状态
C. CO的平衡转化率为80%
D. 反应前H2S物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯中加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先滴有3滴~4滴水的玻璃片上,立即用玻璃棒搅拌。实验过程的示意图如下:
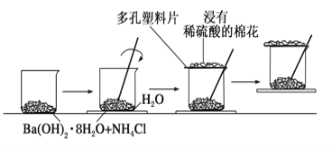
①实验中玻璃棒的作用是:_________。
②浸有稀硫酸的棉花的作用是:_________。
③出现_________现象时,说明该反应为吸热反应。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,其主要成分是甲烷,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用_______能,还能为农业生产提供优良的肥料。已知:标准状况下112.0L CH4气体完全燃烧生成CO2和液态水时,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为:_________。
②如果上述反应生成的是水蒸气,则反应放出的热量:______4448kJ。(填“>”或“<”或“=”)
(3)钢铁在发生电化学腐蚀时钢铁中少量的碳作为原电池的______极,正极发生的电极反应式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的前四周期元素。BA3能使湿润的红色石蕊试纸变蓝,A、B、C三种原子的电子数之和等于25,D有两种常见氧化物,其中一种颜色是砖红色的。
请回答下列问题:
(1)以上四种元素中,电负性最小的是____(填元素符号);
(2)在BA3、AC中,沸点较高的是____(填化学式),其原因是_____。
(3)B元素组成的常见单质中σ键和π键的个数比是____,D的基态原子的外围电子排布式为______。
(4)化合物BA3的立体构型为_____,其中心原子的杂化轨道类型为_______。
(5)由B、D形成的晶体的晶胞图所示,己知紧邻的B原子与D原子距离为acm。
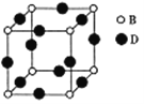
①该晶胞化学式为_____。
②该晶体的密度为_____gcm-3(用含a、NA的代数式表示,设NA为阿伏加德罗常数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化不能实现的是( )
A.Fe(s)![]() FeCl3(s)
FeCl3(s)![]() Fe(OH)3(s)
Fe(OH)3(s)
B.CaCl2(aq)![]() CaCO3(s)
CaCO3(s)![]() CaO(s)
CaO(s)
C.NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(s)
NaOH(s)
D.Al2O3(s)![]() AlCl3(aq)
AlCl3(aq) ![]() Al(OH)3 (s)
Al(OH)3 (s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com