
 O3可通过臭氧发生器电解稀硫酸制得(原理如图).下列有关说法不正确的是( )
O3可通过臭氧发生器电解稀硫酸制得(原理如图).下列有关说法不正确的是( )| A、电极A为阴极 |
| B、质子由A极通过交换膜移向B极 |
| C、若C极通入O2,则A的电极反应式为O2+4e-+4H+═2H2O |
| D、若C处不通入O2,D、E处分别收集到15.68L和6.72L气体(标准状况),则E处收集的气体中O2和O3的体积比为2:1(忽略O3的分解) |
| 15.68L |
| 22.4L/mol |
| xL |
| 22.4L/mol |
| (6.72-x)L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| B、将氢氧化铝加入烧碱溶液中:Al(OH)3+OH-=AlO2-+2H2O |
| C、碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
| D、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
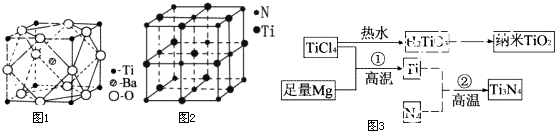
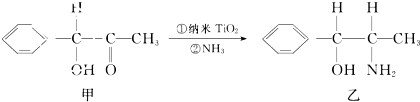
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78 g Na2O2中含有的阴离子数为2NA |
| B、1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
| B、常温,在NH4Cl溶液中,当溶液中c(NH4+)=c(Cl-),pH=7 |
| C、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| D、pH=2的一元强酸和pH=12的一元强碱等体积混合c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的 NaHCO3溶液中:c (Na+)+c (H+)+C(H2CO3)=c (HCO3-)+c(CO32-)+c (OH-) |
| B、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>C(HX)>C(X-)>C(H+)>C(OH-) |
| C、在纯碱溶液中存在:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) |
| D、0.1mol/L HCOOH溶液中:C(HCOO-)+C(OH-)=C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/xl0-4mol L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/xl0-3mol L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com