
A.熔点1
B.熔点
C.能溶于CS2,熔点
D.熔点
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:阅读理解
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显 ▲ 价,A的电负性 ▲ B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。组成蛋白质的最简单的氨基酸中的碳原子杂化态是 ▲ 。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
 (3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图1所示),其中3种离子晶体的晶格能数据如下表:
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图1所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体熔点从高到低的顺序是: ▲ 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的
Mg2+有 ▲ 个。
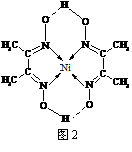 (4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(5)某配合物的分子结构如右图2所示,其分子内不含有
▲ (填序号)。
A. 离子键 B. 极性键 C. 金属键
D. 配位键 E. 氢 键 F. 非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com