
分析 (1)溶液中氢离子浓度越大,溶液的pH越小,根据溶液酸碱性按照pH从小到大进行排序;
(2)pH=4的硫酸中氢离子浓度为1×10-4mol/L,根据硫酸的化学式计算出硫酸的浓度;根据稀释过程中溶质的物质的量不变计算出稀释后硫酸的浓度;根据硫酸的化学式计算出氢离子浓度,然后计算出溶液的pH.
解答 解:(1)①H2SO4 ②Ba(OH)2 ③HI ④NH3•H2O ⑤CH3COOH ⑥H2O中,①③⑤为酸溶液,①为二元强酸,③为一元强酸,⑤为弱酸,则三种溶液的平衡从小到大的顺序为:①③⑤;⑥为中性;②④为碱性溶液,且②为二元强碱,④为一元弱碱,则两溶液的pH大小为:②>④,
所以按pH从小到大的顺序用编号排列为:①③⑤⑥④②,
故答案为:①③⑤⑥④②;
(2)pH=4的硫酸中氢离子浓度为1×10-4mol/L,则硫酸的物质的量浓度为:1×10-4mol/L×$\frac{1}{2}$=5×10-5mol/L;
稀释过程中硫酸的物质的量不变,则稀释后硫酸的浓度为:$\frac{5×1{0}^{-5}mol/L×0.02L}{2L}$=5×10-7mol/L,稀释后溶液中氢离子浓度为:5×10-7mol/L×2=1×10-6mol/L,此时溶液的pH=6,
故答案为:5×10-5;5×10-7;6.
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101kPa条件下,液态水的气化热为40.69kJ•mol-1,则H2O(g)?H2O(l)的△H=40.69kJ•mol-1 | |||||||||||
| B. | 常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 | |||||||||||
| C. | 已知:
 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384kJ•mol-1 | |||||||||||
| D. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 3.51g | C. | 5.02g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )| A. | 可能是N2和NO2的混合气体 | B. | 一定是NO2气体 | ||
| C. | 可能是NO和NO2的混合气体 | D. | 只可能是NO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
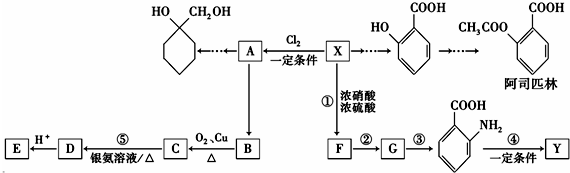

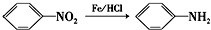 (苯胺,易被氧化)
(苯胺,易被氧化)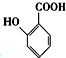 中官能团名称为酚羟基、羧基;
中官能团名称为酚羟基、羧基; ;
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$  +(n-1)H2O;
+(n-1)H2O; 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2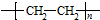
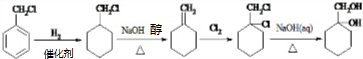 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 加入试剂的化学式 | 有关离子方程式 |
| NaCl(Na2SO4) | ||
| FeCl2(FeCl3) | ||
| Na2CO3 溶液(NaHCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com