
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 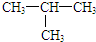 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 4:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | CH3CH2OH | C. | CH3CHO | D. | C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 在同一周期中,ⅠA族单质的活泼性比ⅡA族的弱 | |
| C. | 所有主族元素的最高化合价数与它的族序数数值相等 | |
| D. | 同主族元素的气态氢化物,相对分子质量越大,沸点不一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com