
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛,请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+)_________(填“=”、“>” 或“<”)NH4HSO4中c(NH4+)。
(2)如图一是0.1 molL-1 NH4Al(SO4)2溶液的pH随温度变化的图象。
①其中符合0.1 molL-1 NH4Al(SO4)2的pH随温度变化的曲线是___________(填写字母);
②室温时,0.1 molL-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=_________molL-1(填数值)
(3)室温时,向100 mL 0.1molL-1 NH4HSO4溶液中滴加0.1molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图二所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____________;在c点,溶液中各离子浓度由大到小的排列顺序是____________ 。
【答案】
(1)>;
(2)①Ⅰ;②10-3(或10-3-10-11);
(3)a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)。
【解析】
试题分析:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,NH4+水解程度水解程度越大,pH越大,因此pH相同的NH4Al(SO4)2中c(NH4+)>NH4HSO4中c(NH4+),故答案为:>;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,故答案为:Ⅰ;②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 molL-1[c(OH-)太小,可忽略],故答案为:10-3 molL-1;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,d点溶液呈碱性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,a点时c(Na+)=c(SO42-),d点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+),故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法不正确的是
物质 | 试剂 | 分离方法 | |
A | 淀粉溶液(NaCl) | 水 | 渗析 |
B | CaCO3(CaO) | 水 | 过滤 |
C | KCl溶液(I2) | 酒精 | 萃取 |
D | CO2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
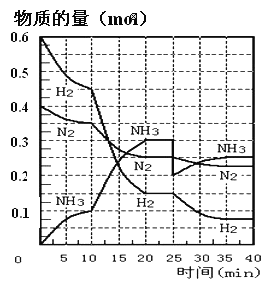
(1)10min内用NH3表示该反应的平均速率,v(NH3)= _______。
(2)在10-20min内NH3浓度变化的原因可能是_______(填字母)。
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成mmolN2的同时消耗3mmolH2
f.amolN=N键断裂的同时,有6amolN-M键合成
(4)第一次平衡时,平衡常数K1=____(用数学表达式表示)。NH3的体积分数是_____(保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨气完全燃烧生成气态水的热化学方程式是______
(7)安阳燃料电池具有很大的发展潜力。安阳燃料电池工作原理如图所示:
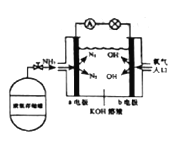
①b电极的电极反应式是_________;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是
选项 | a | b | c |
|
A | Cu | CuO | Cu(OH)2 | |
B | SiO2 | Na2SiO3 | H2SiO3 | |
C | AlCl3 | NaAlO2 | Al(OH)3 | |
D | CaO | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组以一种工业废料制备高纯MgO,设计了流程如下。

请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为______________
(2)下列物质可用于代替步骤②中H2O2的是__________
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+

ⅰ.实验装置图中仪器A的名称为________________
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:________________
ⅲ.图中存在的错误是:________________
(4)步骤④中NaOH加入的量是______________ (填“少量”或“过量”)
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为____________(![]() )
)
(6)高纯氧化镁可能具有如下性质和用途,正确的是____________
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10) 三种物质中,下列说法正确的是 ( )
A.Mg(OH)2不能转化为Ca(OH)2 B.Ca(OH)2的溶解度最小
C.Ca(OH)2不能转化为 Mg(OH)2 D.Ksp越大,S不一定越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时加水稀释10 mL pH=11的氨水,下列判断正确的是 ( )
A.原氨水的浓度为10-3mol·L-1
B.溶液中![]() 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备四氯化硅液体的装置。已知:四氯化硅熔点为-70℃,沸点57.6℃,遇水极易反应。

请回答下列问题。
(1)写出装置A中发生反应的化学方程式_______________________________
(2)装置B中盛放的试剂是____________;装置C的作用是___________
(3)g管的作用是_________________________________
(4)装置E中冰水的作用是_________________________________________
(5)干燥管F中碱石灰的作用是___________________和________________________
(6)若要用装置B、C代替装置F,则装置B、C中应盛放的试剂分别是_____、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数由小到大排列的五种短周期元素,其中A、B、C、D的原子序数之和为32,A是元素周期表中原子半径最小的元素,B、C左右相邻,C、D位于同主族.
(1)E元素原子的结构示意图为: ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式: .
(2)A与C组成的化合物的电子式为 ,其中含有的化学键为 (填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
(3)A、B、C、D四种元素中的三种能组成一种强酸,该强酸的稀溶液能与铜反应,其中起氧化性作用的酸占消耗酸总物质的量的百分比是 .
(4)由A、B、C、D四种元素组成的一种离子化合物X.
①已知1mol X能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下X与NaOH浓溶液反应的离子方程式: .
②又知X既能与盐酸反应,又能与氯水反应,写出X的化学式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com