
利用如图装置探究铁在海水中的电化学腐蚀与防护.下列说法不正确的是()
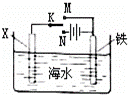
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH﹣﹣4e﹣=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e﹣+2H2O=4OH﹣
考点: 原电池和电解池的工作原理.
 专题: 电化学专题.
专题: 电化学专题.
分析: A.若X为锌棒,开关K置于M处,该装置是原电池,锌作负极,铁作正极;
B.若X为锌棒,开关K置于N处,该装置是电解池,锌作阳极,阳极上锌失电子发生氧化反应;
C.若X为碳棒,开关K置于N处,该装置是电解池,碳作阳极,铁作阴极,阴极被保护;
D.若X为碳棒,开关K置于M处,该装置是原电池,X是正极,正极上得电子发生还原反应.
解答: 解:A.若X为锌棒,开关K置于M处,该装置是原电池,锌作负极,铁作正极而被保护,采用了牺牲阳极的阴极保护法,故A正确;
B.若X为锌棒,开关K置于N处,该装置是电解池,锌作阳极,阳极上锌失电子发生氧化反应,电极反应式为:Zn﹣2e﹣→Zn2+,故B错误;
C.若X为碳棒,开关K置于N处,该装置是电解池,碳作阳极,铁作阴极,阴极被 保护,采用了采用了外加电流的阴极保护法,故C正确;
保护,采用了采用了外加电流的阴极保护法,故C正确;
D.若X为碳棒,开关K置于M处,该装置是原电池,X是正极,正极上得电子发生还原反应生成氢氧根离子,电极反应式为::O2+4e﹣+2H2O=4OH﹣,故D正确;
故选B.
点评: 本题考查了原电池和电解池原理,注意当活泼电极作电解池阳极时,阳极上金属材料失电子而不是电解质 溶液中阴离子失电子,为易错点.
溶液中阴离子失电子,为易错点.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 含有最低价元素的化合物不一定具有很强的还原性
B. 元素的单质一定是由氧化或还原该元素的化合物制得
C. 阳离子只能得电子被还原,阴离子只能失电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年1月初华北地区连续5~6天出现大雾,致使高速公路封闭、飞机停飞.雾属于下列分散系中的()
A. 胶体 B. 悬浊液 C. 溶液 D. 乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH固体配制250mL 0.2mol•L﹣1 NaOH溶液.
(1)经计算需用NaOH固体 g
(2)配制该溶液用到的仪器有除托盘天平、烧杯、玻璃棒、量筒外,还有容量瓶;
(3)容量瓶上标有以下五项中的 (填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)配制溶液时,正确的操作顺序是(用字母表示,每个字母只能用一次) 并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液 .
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有 (填序号).
A.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
B.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
C.容量瓶刚用蒸馏水洗净,没有烘干.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验现象的描述不正确的是()
A. 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B. 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
国外新近研制的溴化锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液. 现有四个电极反应:①Zn﹣2e=Zn2+ ②Zn2++2e=Zn ③Br2+2e=2Br﹣ ④2Br﹣﹣2e=Br2.那么,充电时的阳极和放电时的负极反应分别是()
A. ④① B. ②③ C. ③① D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
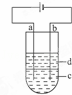
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
(1)a电极材料应为 ,电极反应式 ;
(2)电解液c可以是(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为 ,在加入苯之前对c应作怎样的简单处理? .
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,浓度都为1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z.反应2min后,测得 X2的浓度为0.4mol/L,用Y2的变化表示的反应速率v(Y2)=0.1mol/(L•min),生成的c(Z)=0.4mol/L,如z用X、Y表示,则该反应方程式是()
A. X2+2Y2═2XY2 B. 2X2+Y2═2X2Y C. 3X2+Y2═2X3Y D. X2+3Y2═2XY3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com