
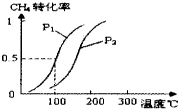
 �״�����Ϊ2l���͵�����ȼ�ϣ������״����й����⣮
�״�����Ϊ2l���͵�����ȼ�ϣ������״����й����⣮| ʵ���� | T���棩 | n ��CO��/n��H2�� | P��MPa�� | ||
| 1 | 150 |
| 0.1 | ||
| 2 |
| 5 | |||
| 3 | 350 | 5 |
| 1 |
| 3 |
| 1mol��0.5 |
| 100L |
| 0.0153��0.005 |
| 0.015��0.005 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 13 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| NaOH��Һ���/mL����0.13molNaOH�� | 40.00 | 40.00 | 40.00 |
| ��Ʒ����/g | 7.75 | 15.50 | 23.25 |
| ��������/g | 1.87 | 1.87 | 1.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����̼��������Һ�м������HCO3-+H+=CO2��+H2O |
| B���ѽ���������ϡ�����У�2Fe+6H+=2Fe3++3H2�� |
| C�����Ȼ�������Һ��ͨ��������Fe2++Cl2=Fe3++2Cl- |
| D���Ƹ�ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.3mol/L |
| B��0.7mol/L |
| C��0.8 mol/L |
| D��1.5mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��MnO2�� |
| B��WO3 |
| C��Fe3O4 |
| D��Cr2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu��Mg |
| B��Zn��Fe |
| C��Na��Al |
| D��Al��Fe |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A����AΪŨ���ᣬBΪMnO2��C��ʢƷ����Һ����C����Һ��ɫ |
| B����AΪ���ᣬBΪ���ǣ�C��ʢ����ʯ��ˮ����C����Һ�ޱ仯 |
| C����AΪŨ��ˮ��BΪ��ʯ�ң�C��AlCl3��Һ����C���Ȳ�����ɫ������������ܽ� |
| D��ʵ������D��Ҫ��ֹ��Һ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com