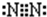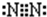已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18.下列框图中部分反应条件已略去.
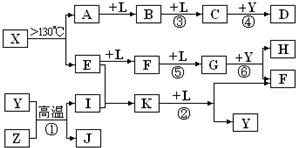
试回答下列问题:
(1)下列有关X的说法正确的是
AB
AB
.
A.该物质的分子式为S
4N
4B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S
2N
2互为同素异形体
(2)E的电子式为
,D的分子式
H2SO4
H2SO4
,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是
④
④
.(填序号)
(3)写出反应②的化学方程式:
.
(4)J与过量H的稀溶液反应的离子方程式为
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
.