��2013?���ݶ�ģ����ѧ��Ӧԭ���ڹ�ҵ�����о���ʮ����Ҫ�����壮
��1���ϳɰ��õ������ж�����ȡ����������д����C�Ʊ�ˮú���Ļ�ѧ��Ӧ����ʽ
������������Ȼ����������ȡ������CH
4+H
2O��g��
CO+3H
2���Ƚ��������ַ���ת��6mol����ʱ��C��CH
4������֮����
9��4
9��4
��
��2����ҵ����������NH
3��g����CO
2��g������������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�
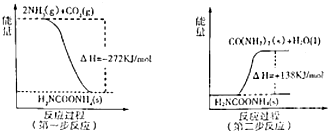
��NH
3��g����CO
2��g����Ӧ�������ص��Ȼ�ѧ����ʽΪ
2NH3��g��+CO2��g��?H2O��l��+H2NCONH2��s����H=-134kJ?mol-1
2NH3��g��+CO2��g��?H2O��l��+H2NCONH2��s����H=-134kJ?mol-1
��
��3����֪��ӦFe��s��+CO
2��g��?FeO��s��+CO��g����H=��kJ?mol
-1������ڲ�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ��K���¶ȵı仯���£�
| �¶ȣ��棩 |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=
��a
��
��
0�������������������������500��2L�ܱ������н��з�Ӧ��Fe��CO
2����ʼ����Ϊ4mol����5min��ﵽƽ��ʱCO
2��ת����Ϊ
50%
50%
������CO��ƽ������v��CO��Ϊ
0.2mol/��Lmin��
0.2mol/��Lmin��
��
��700�淴Ӧ�ﵽƽ���Ҫʹ��ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ��
C
C
������ĸ����
A����С��Ӧ���ݻ� B������Fe�����ʵ��� C�������¶ȵ�900��D��ʹ�ú��ʵĴ�����




 ��У����ϵ�д�
��У����ϵ�д�